高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
常温下,往足量草酸钙固体与水的混合体系中加盐酸或$\rm NaOH$调节$\rm pH$时,$\lg c\rm(H_{2}C_{2}O_{4})$,$\rm lg \textit{c}\rm(HC_{2}O_{\text{4}}^{-}\rm )$,$\rm lg\textit{c}(C_{2}O_{4}^{2-}\rm )$与$\rm pH$变化关系如图所示。下列说法错误的是$(\qquad)$
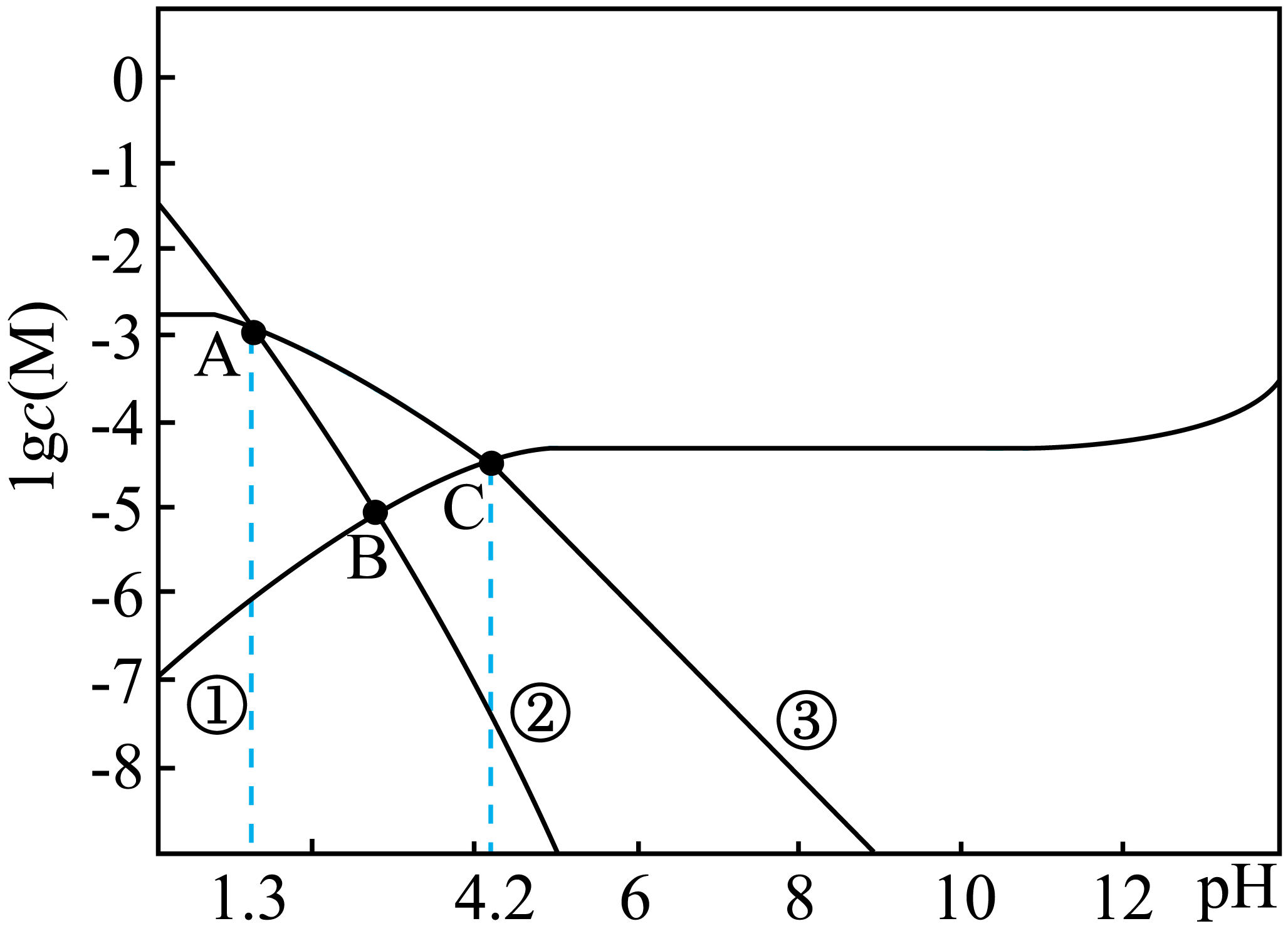
曲线③表示$\\rm C_{2}O_{4}^{2-}$的变化情况
","$\\rm H_{2}C_{2}O_{4}$的$K_\\rm{a2}=10^{-4.2}$
","$\\rm pH=7$时,$c\\rm(HC_{2}O_{\\text{4}}^{-}\\rm )+2\\textit{c}(C_{2}O_{4}^{2-}\\rm )=2\\textit{c}(Ca^{2+})$
","$\\rm pH\\gt 12$后,曲线①呈上升趋势的原因是部分$\\rm CaC_{2}O_{4}$转化为$\\rm Ca(OH)_{2}$
"]$\rm CaC_{2}O_{4}$体系中存在一系列平衡,$\text{Ca}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}\text{(s)}\rightleftharpoons \text{C}{{\text{a}}^{\text{2+}}}\text{(aq)+}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{\text{2-}}\text{(aq)}$、$\rm C_{2}O_{4}^{2-}+H_{2}O\rightleftharpoons HC_{2}O_{4}^{-}+OH^{-}$、$\text{H}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{-}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons {{\text{H}}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}\text{+O}{{\text{H}}^{-}}$,所以在$\rm CaC_{2}O_{4}$溶液中,增大$\rm pH$,后两个平衡逆向移动,草酸根浓度增大,其正对数增大,①表示${{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{\text{2-}}$;增大$\rm pH$的过程中,后这个平衡均逆向移动,草酸氢根减小程度缓于草酸分子,②表示$\rm H_{2}C_{2}O_{4}$、③表示$\text{H}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{-}$。
$\rm A$.由分析可知,曲线③表示$\text{H}{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{-}$的变化情况,$\rm A$错误;
$\rm B$.${{\textit{K}}_{\text{a2}}}=\dfrac{\textit{c}{{\text{(H}}^{+}}\text{)}\cdot \textit{c}{{\text{(C}}_{2}}\text{O}_{\text{4}}^{\text{2-}}\text{)}}{\textit{c }{{\text{(H C}}_{2}}\text{O}_{\text{4}}^{-}\text{)}}$,①③相交时$c{{\text{(C}}_{\text{2}}}\text{O}_{\text{4}}^{\text{2-}})=\textit{c} \rm(H{{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{-}\text{)}$,此时$\rm pH=4.2$,可得$K_\rm{a2}=10^{-4.2}$,$\rm B$正确;
$\rm C$.溶液$\rm pH=7$时$c\rm(H^{+})=\textit{c}(OH^{-})$,溶液中电荷守恒$\textit{c}\left( \text{H}\text{C}_{\text{2}}\text{O}_{\text{4}}^{-}\right)+2\textit{c}\left( \text{C}_{\text{2}}\text{O}_{\text{4}}^{\text{2-}}\right)+\textit{c }\text{(OH}^{-}\text{)=2}c\left( \text{C}\text{a}^{\text{2+}}\right)+\textit{c}\text{(H}^{+}\text{)}$,但是没有考虑到加入盐酸或者氢氧化钠以后提供的氯离子或钠离子,所以$\textit{c}\left( \text{H}\text{C}_{\text{2}}\text{O}_{\text{4}}^{-}\right)\text{+2}\textit{c}\left( \text{C}_{\text{2}}\text{O}_{\text{4}}^{\text{2-}}\right)\text{=2}\textit{c}\left( \text{C}\text{a}^{\text{2+}}\right)$错误,$\rm C$错误;
$\rm D$.溶液中存在${{\textit{K}}_\rm{sp}}\left( \text{Ca}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}} \right)=\textit{c}\left( \text{C}{{\text{a}}^{\text{2+}}} \right)\times\!\!\textit{ c}\left( {{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{\text{2-}} \right)$,$\rm pH\gt 12$后,$\textit{c}\rm\left( OH^{-}\right)$增大,导致$\textit{Q}\rm \left[ Ca\left( OH\right)_{2}\right]>\textit{K}_{sp}\left[ Ca\left( OH\right)_{2}\right]$,生成$\rm Ca\left( OH\right)_{2}$导致$c\left( \text{C}{{\text{a}}^{\text{2+}}} \right)$减小,则$c\left( {{\text{C}}_{\text{2}}}\text{O}_{\text{4}}^{\text{2-}} \right)$上升,$\rm D$正确;
故选:$\rm AC$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
