高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
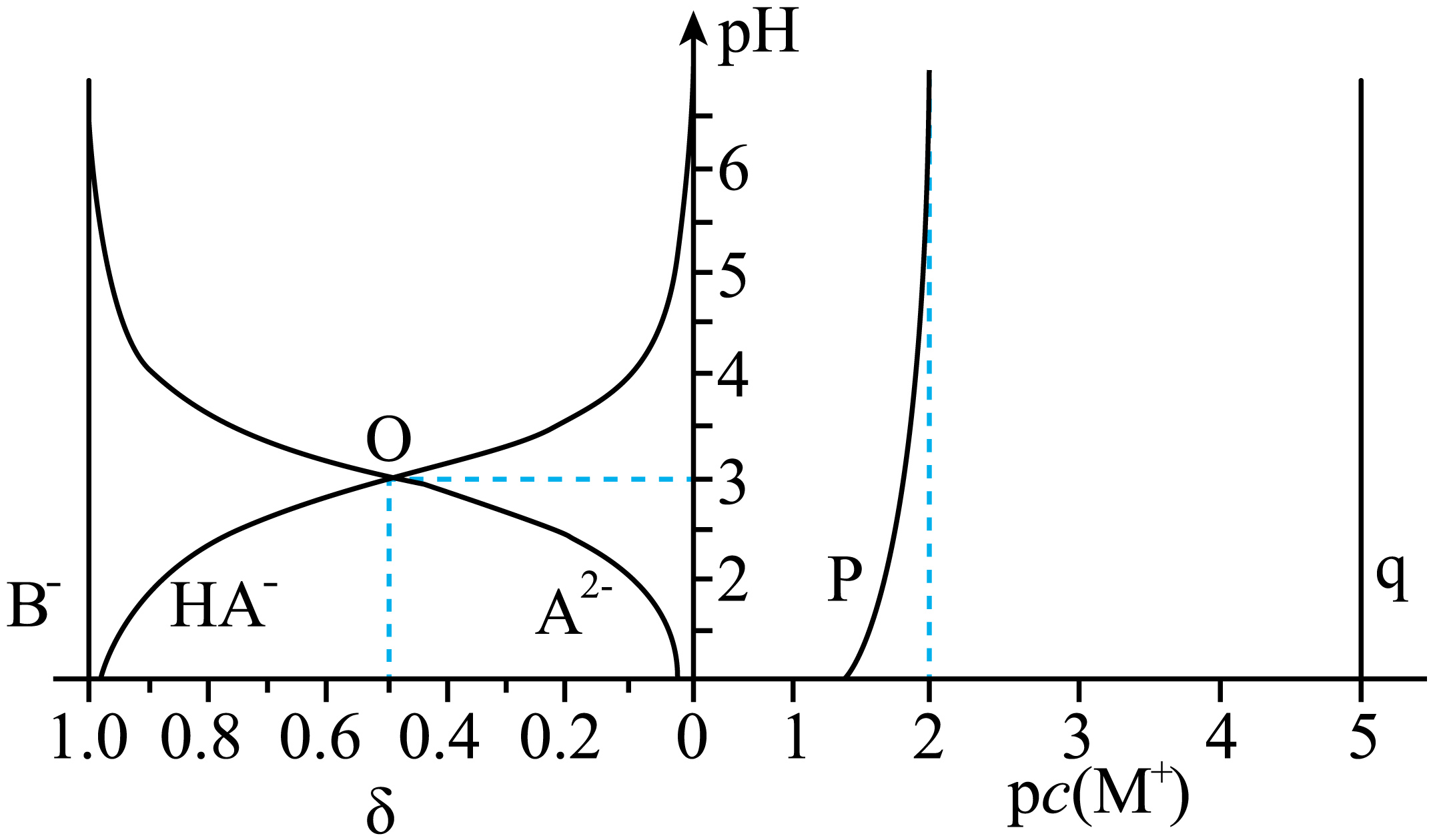
常温下,有含$\rm M_{2}A(s)$的$\rm M_{2}A$饱和溶液、含$\rm MB(s)$的$\rm MB$饱和溶液,两份溶液中$\rm p\textit{c}\left(\rm M^{+}\right)\left( p\textit{c}=-\lg \textit{c}\right)$和微粒的分布系数$\delta[\delta\left( {{\text{A}}^{\text{2-}}} \right){=c}\left( {{\text{A}}^{\text{2-}}} \right)/所有含\rm A微粒的总浓度 ]$,随$\rm pH$的变化关系如图所示,${{\text{M}}^{+}}$不发生水解,$\rm MHA$可溶。
下列说法正确的是$(\qquad)$
$\\rm P$表示$\\rm MB$饱和溶液中$\\text{p}c\\left( \\text{M}^{+}\\right)$随$\\rm pH$变化的图像
","反应${{\\text{M}}_{\\text{2}}}\\text{A}\\left( \\text{s} \\right)\\text{+2}{{\\text{B}}^{-}}+{{\\text{H}}^{+}}\\rightleftharpoons \\text{2MB}\\left( \\text{s} \\right)\\text{+H}{{\\text{A}}^{-}}$的平衡常数约为$\\rm 5\\times 10^{16}$
","$\\rm MHA$与少量$\\rm HB$反应的离子方程式为:$\\text{H}{{\\text{A}}^{-}}+{{\\text{H}}^{+}}={{\\text{H}}_{\\text{2}}}\\text{A}$
","$\\rm pH=3$时,$\\rm M_{2}A$的饱和溶液中${c}\\left( \\text{H}^{+}\\right){+c}\\left( \\text{M}^{+}\\right)\\lt{3c}\\left( \\text{H}\\text{A}^{-}\\right){+c}\\left( \\text{O}\\text{H}^{-}\\right)$
"]含$\rm A$微粒的分布系数曲线只有一个交点,说明${{\text{H}}_{\text{2}}}\text{A}$第一步完全电离,第二步部分电离,含$\rm A$微粒只有$\text{H}{{\text{A}}^{-}}$和${{\text{A}}^{2-}}$,二者浓度相等时:$\rm pH=3$,则$\text{H}{{\text{A}}^{-}}$电离常数$=c\left( \text{H}^{+}\right)=10^{-3}$;含$\rm B$微粒的分布系数曲线只有${{\text{B}}^{-}}$一条曲线,且$\rm \delta=1$,则$\rm HB$为强酸,在水溶液中完全电离,则$\mathrm{M}^{+}$浓度改变,${{\text{M}}_{2}}\text{A}$饱和溶液的$\rm pH$改变,$\rm MB$饱和溶液的$\rm pH$不变,即$\rm p$表示${{\text{M}}_{2}}\text{A}$饱和溶液中$\text{p}c\left( \text{M}^{+}\right)$随$\rm pH$变化的图像,$\rm q$表示$\rm MB$饱和溶液中$\text{p}c\left( \text{M}^{+}\right)$随$\rm pH$变化的图像。据此解答:
$\rm A$. 根据分析,$\rm HB$为强酸,${{\text{B}}^{-}}$不发生水解,$\mathrm{M}^{+}$浓度改变$\rm MB$溶液$\rm pH$不变,而 ${{\text{H}}_{\text{2}}}\text{A}$第一步完全电离,第二步部分电离,${{\text{A}}^{2-}}$在水溶液中会发生水解,$\mathrm{M}^{+}$浓度改变$\rm M_{2}A$溶液$\rm pH$变化,因此$\rm P$表示${{\text{M}}_{2}}\text{A}$饱和溶液中$\text{p}c\left( \text{M}^{+}\right)$随$\rm pH$变化的图像,故$\rm A$错误;
$\rm B$.根据分析,$\mathrm{M}^{+}$、${{\text{B}}^{-}}$均不发生水解,所以$\rm MB$饱和溶液中$\text{p}c\left( \text{M}^{+}\right)$不随$\rm pH$变化,则$\rm q$代表$\rm MB$饱和溶液中$\text{p}c\left( \text{M}^{+}\right)$,$\rm p$代表${{\text{M}}_{2}}\text{A}$饱和溶液中$\text{p}c\left( \text{M}^{+}\right)$随$\rm pH$发生变化,据图可知,$\rm pH=6$时,${{\text{M}}_{2}}\text{A}$饱和溶液中$\text{p}c\left( \text{M}^{+}\right)=2$,$c\left( \text{M}^{+}\right)=0.01\ \text{mol/L}$,此时,溶液中只有${{\text{A}}^{2-}}$,则$c\left( \text{A}^{2-}\right)=\dfrac{1}{2}c\left( \text{M}^{+}\right)=0.005\text{ mol/L}$,那么${{K}_{\text{sp}}}({{\text{M}}_{\text{2}}}\text{A})={{c}^{2}}\left( {{\text{M}}^{+}} \right)\cdot c\left( {{\text{A}}^{2-}} \right)={{0.01}^{2}}\times 0.005=5\times {{10}^{-7}}$,$\rm MB$饱和溶液中$\text{p}c\left( \text{M}^{+}\right)=5$,$c\left( \text{B}^{-}\right)=c\left( \text{M}^{+}\right)=10^{-5}\text{ mol/L}$,${{K}_{\text{sp}}}(\text{MB})=c\left( {{\text{M}}^{+}} \right)\cdot c\left( {{\text{B}}^{-}} \right)={{10}^{-5}}\times {{10}^{-5}}=1\times {{10}^{-10}}$,根据$\text{H}{{\text{A}}^{-}}$和${{\text{A}}^{2-}}$二者浓度相等时$\rm pH=3$,得出$\text{H}{{\text{A}}^{-}}$电离常数${{K}_{\text{a}}}(\text{H}{{\text{A}}^{-}})=c\left( {{\text{H}}^{+}} \right)={{10}^{-3}}$因此反应${{\text{M}}_{\text{2}}}\text{A}\left( \text{s} \right)\text{+2}{{\text{B}}^{-}}+{{\text{H}}^{+}}\rightleftharpoons \text{2MB}\left( \text{s} \right)\text{+H}{{\text{A}}^{-}}$的平衡常数:$K=\dfrac{c(\text{H}\text{A}^{-})}{c\left( \text{H}^{+}\right)\cdot c^{2}\left( \text{B}^{-}\right)}=\dfrac{c(\text{H}\text{A}^{-})}{c\left( \text{H}^{+}\right)\cdot c^{2}\left( \text{B}^{-}\right)}\cdot\dfrac{c\left( \text{A}^{2-}\right)}{c(\text{A}^{2-})}\cdot\dfrac{c^{2}\left( \text{M}^{+}\right)}{c^{2}\left( \text{M}^{+}\right)}=\dfrac{K_{\text{sp}}(\text{M}_{\text{2}}\text{A})}{K_{\rm a}(\text {HA}^{-})[K_{\text{sp}}(\text{MB})]^{2}}=\dfrac{5\times10^{-7}}{10^{-3}\times(10^{-10})^{2}}=5\times10^{16}$,故$\rm B$正确;
$\rm C$.$\rm MHA$在水溶液中完全电离为$\mathrm{M}^{+}$和$\text{H}{{\text{A}}^{-}}$,$\rm HB$在水溶液中完全电离为${{\text{H}}^{+}}$和${{\text{B}}^{-}}$,由于${{K}_{\text{sp}}}(\text{MB})=c\left( {{\text{M}}^{+}} \right)\cdot c\left( {{\text{B}}^{-}} \right)={{10}^{-5}}\times {{10}^{-5}}=1\times {{10}^{-10}}$,因此$\rm MB$是难溶化合物,由于${{\text{H}}_{\text{2}}}\text{A}$第一步完全电离,因此$\text{H}{{\text{A}}^{-}}$不与反应${{\text{H}}^{+}}$,则$\rm MHA$与少量$\rm HB$反应的离子方程式为:${{\text{M}}^{+}}+{{\text{B}}^{-}}\text{=MB}\downarrow $,故$\rm C$错误;
$\rm D$.当溶液$\rm pH=3$时,$\delta \left( \text{H}{{\text{A}}^{-}} \right)=\delta \left( {{\text{A}}^{2-}} \right)$,$c\left( \text{H}{{\text{A}}^{-}} \right)=c\left( {{\text{A}}^{2-}} \right)$,溶液中存在物料守恒$c\left( {{\text{M}}^{+}} \right)=2\left[ c\left( \text{H}{{\text{A}}^{-}} \right)+c\left( {{\text{A}}^{2-}} \right) \right]=4c\left( \text{H}{{\text{A}}^{-}} \right)$,电荷守恒$c\left( \text{H}^{+}\right){+c}\left( \text{M}^{+}\right){=2c(}\text{A}^{\text{2-}}{)+c}\left( \text{H}\text{A}^{-}\right){+c}\left( \text{O}\text{H}^{-}\right)=3{c}\left( \text{H}\text{A}^{-}\right){+c}\left( \text{O}\text{H}^{-}\right)$,故$\rm D$错误;
故选:$\rm B$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
