高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
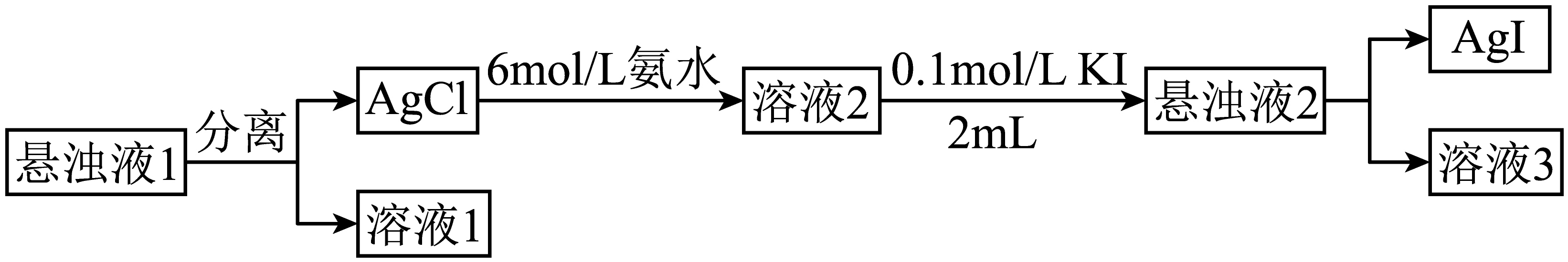
某兴趣小组探究沉淀的转化。将$\rm 2\;\rm mL$ $\rm 0.1\;\rm mol·L^{-1}$ $\rm AgNO_{3}$溶液与同浓度同体积的$\rm NaCl$溶液混合,得悬浊液$\rm 1$,然后进行如下实验。下列叙述错误的是$(\qquad)$
溶液$\\rm 1$中${c}\\left( \\text{A}{{\\text{g}}^{+}} \\right)+{c}\\left( \\text{N}{{\\text{a}}^{+}} \\right)+{c}\\left( {{\\text{H}}^{+}} \\right)={c}\\left( \\text{C}{{\\text{l}}^{-}} \\right)+{c}\\left( \\text{NO}_{3}^{-} \\right)+{c}\\left( \\text{O}{{\\text{H}}^{-}} \\right)$
","溶液$\\rm 2$中${c}\\left( \\text{C}{{\\text{l}}^{-}} \\right)\\gt {c}\\left( {{\\left[ \\text{Ag}{{\\left( \\text{N}{{\\text{H}}_{3}} \\right)}_{2}} \\right]}^{+}} \\right)$
","溶液$\\rm 3$中${c}\\left( {{\\text{H}}^{+}} \\right)={c}\\left( \\text{O}{{\\text{H}}^{-}} \\right)$
","上述实验可证明${{{K}}_{\\text{sp}}}\\left( \\text{AgCl} \\right)\\gt {{{K}}_{\\text{sp}}}\\left( \\text{AgI} \\right)$
"]在$\rm 2\;\rm mL\;\rm 0.2\;\rm mol/L$的$\rm \text{AgN}{{\text{O}}_{3}}$溶液中加入等体积等浓度的$\rm NaCl$溶液得悬浊液$\rm 1$,经分离后,向$\rm AgCl$中滴加$\rm 6\;\rm mol/L$的氨水,发生反应$\rm \text{AgCl+2N}{{\text{H}}_{3}}\cdot{{\text{H}}_{2}}\text{O=}\left[ \text{Ag}{{\left( N{{H}_{3}} \right)}_{2}} \right]\text{Cl+2}{{\text{H}}_{2}}\text{O}$,加入$\rm 0.1\;\rm mol/L\;KI$溶液$\rm 2\;\rm mL$,发生反应:$\rm \left[ \text{Ag}{{\left( N{{H}_{3}} \right)}_{2}} \right]Cl+KI=AgI\downarrow +KCl+2N{{H}_{3}}$,得到$\rm AgI$沉淀,由物质的量关系可知,$\rm \left[ \text{Ag}{{\left( N{{H}_{3}} \right)}_{2}} \right]Cl$不能完全反应,溶液$\rm 3$中可能还存在剩余的氨水以及$\rm \left[ \text{Ag}{{\left( N{{H}_{3}} \right)}_{2}} \right]Cl$;
$\rm A$.溶液$\rm 1$中主要溶质是$\rm NaN{{O}_{3}}$,同时由于存在溶解平衡:$\rm AgCl\left( \text{s} \right)\rightleftharpoons A{{g}^{+}}\left( aq \right)+C{{l}^{-}}\left( aq \right)$,还存在极少量的$\rm A{{g}^{+}}$、$\rm C{{l}^{-}}$,选项中满足电荷守恒关系,$\rm A$正确;
$\rm B$.根据元素守恒可知,若$\rm A{{g}^{+}}$不水解,则${c}\left( \text{C}{{\text{l}}^{-}} \right) {=c}\left( {{\left[ \text{Ag}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{2}} \right]}^{+}} \right)$,但$\rm A{{g}^{+}}$会水解生成其他含银的微粒,故${c}\left( \text{C}{{\text{l}}^{-}} \right)\gt {c}\left( {{\left[ \text{Ag}{{\left( \text{N}{{\text{H}}_{3}} \right)}_{2}} \right]}^{+}} \right)$,$\rm B$正确;
$\rm C$.溶液$\rm 3$中可能存在氨水过量的情况,不能得出${c}\left( {{\text{H}}^{+}} \right)={c}\left( \text{O}{{\text{H}}^{-}} \right)$的结论,$\rm C$错误;
$\rm D$.由实验操作可知,存在转化$\rm \text{AgCl}\overset{N{{H}_{3}}\cdot{{\text{H}}_{2}}\text{O}}{\mathop{\to }}\,\left[ \text{Ag}{{\left( N{{H}_{3}} \right)}_{2}} \right]Cl\overset{KI}{\mathop{\to }}\,AgI$,由此说明$\rm AgI$更难溶,故可得出结论${{{K}}_{\text{sp}}}\left( \text{AgCl} \right)\gt {{{K}}_{\text{sp}}}\left( \text{AgI} \right)$,$\rm D$正确。
故选:$\rm C$
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
