高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
废弃电池中锰可通过浸取回收。某温度下,在$\text{MnS}{{\text{O}}_{4}}$和$\text{KOH}$混合溶液中,$\text{Mn}\left( \text{II} \right)$的分布系数$\delta$与$\text{pH}$的关系如图。
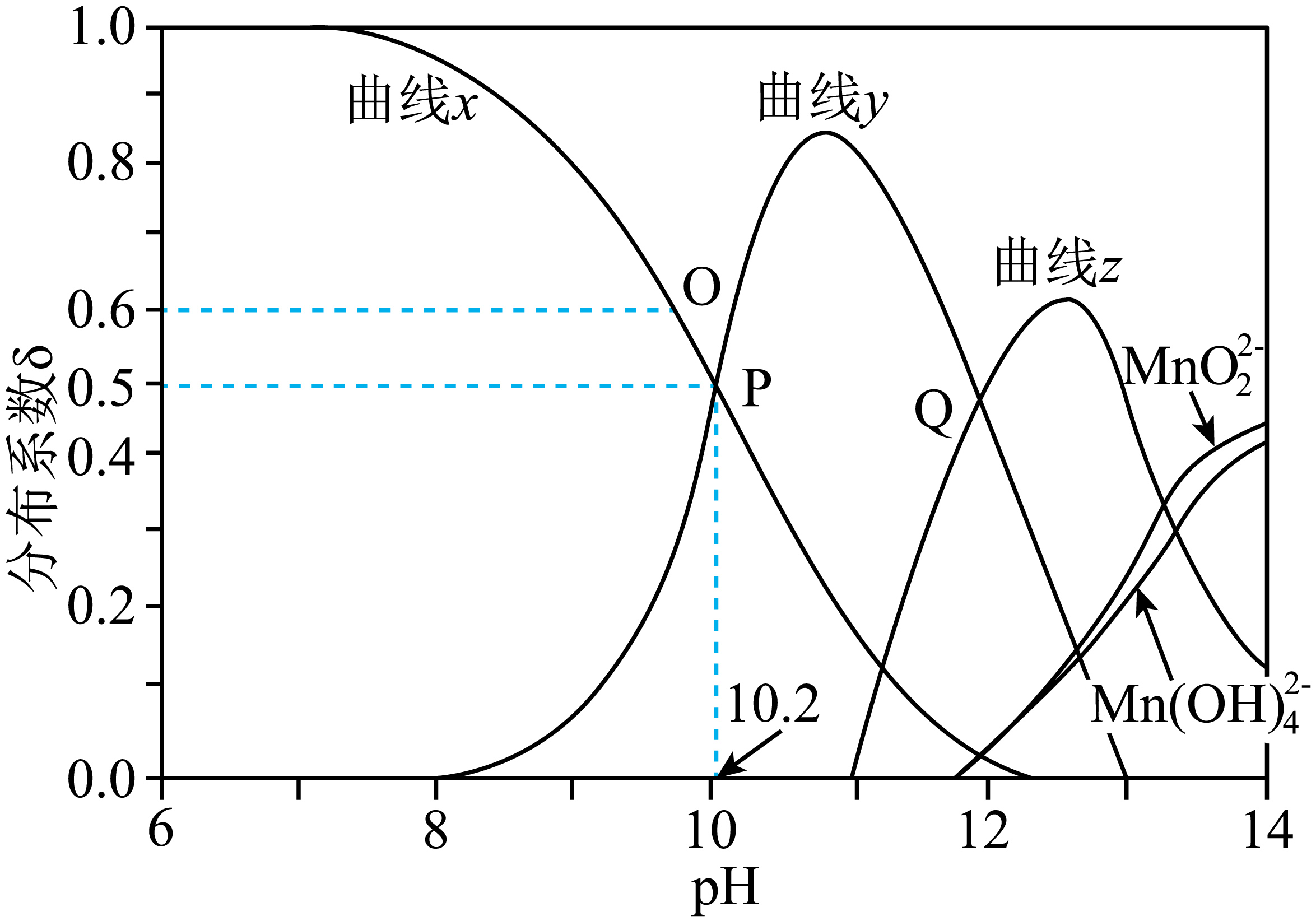
已知:$\text{Mn}{{\left( \text{OH} \right)}_{2}}$难溶于水,具有两性;$\delta\left( \text{MnO}\text{H}^{+}\right)=\dfrac{{c}\left( \text{MnO}\text{H}^{+}\right)}{{c}\left( \text{M}\text{n}^{\text{2+}}\right){+c}\left( \text{MnO}\text{H}^{+}\right){+c}\left( \text{HMnO}_{\text{2}}^{-}\right){+c}\left[ \text{Mn(OH)}_{\text{4}}^{\text{2-}}\right]{+c}\left( \text{MnO}_{\text{2}}^{\text{2-}}\right)}$。下列说法错误的是$(\qquad)$
曲线$y$代表$\\delta \\left( \\text{MnO}{{\\text{H}}^{+}} \\right)$的变化
","$\\text{P}$点,$c\\left( \\text{M}\\text{n}^{2+}\\right)\\lt c\\left( \\text{K}^{+}\\right)$
","$\\mathrm{O}$点,$c\\left( {{\\text{H}}^{+}} \\right)=\\dfrac{2}{3}\\times {{10}^{-10.2}}$
","$\\text{Q}$点,${c}\\left( \\text{SO}_{4}^{2-}\\right)\\gt2{c}\\left( \\text{MnO}\\text{H}^{+}\\right)+2{c}\\left( \\text{MnO}_{2}^{2-}\\right)$
"]$\rm Mn{{\left( OH \right)}_{2}}$难溶于水,具有两性,某温度下,$\rm MnS{{O}_{4}}$在不同浓度的$\rm KOH$水溶液中,结合曲线变化和分布分数可知,$\rm pH$较小时,$\rm Mn$元素存在形式为$\rm M{{n}^{2+}}$,则曲线$x$为$\rm Mn^{2+}$,随着加入氢氧化钾的增加,碱性逐渐增强,所以曲线$y$为$\rm MnOH^{+}$,根据分布系数提供的离子,则曲线$z$为$\rm HMnO_{2}^{-}$。
$\rm A$.根据分析可知,随着加入氢氧化钾的增加,碱性逐渐增强,曲线$y为\rm MnOH^{+}$,$\rm A$正确;
$\rm B$.$\rm \operatorname{P}$点时$\rm \delta\left( Mn^{2+}\right)=\delta\left( MnOH^{+}\right)=0.5$,溶液中含$\rm Mn$元素微粒只有这两种,根据物料守恒有①$\rm \textit{c}\left( Mn^{2+}\right)+\textit{c}\left( MnOH^{+}\right)=\textit{c}\left( SO_{4}^{2-}\right)$,且$\rm \textit{c}\left( Mn^{2+}\right)=\textit{c}\left( MnOH^{+}\right)$, ②$\rm 2\textit{c}\left( Mn^{2+}\right)=\textit{c}\left( SO_{4}^{2-}\right)$,根据电荷守恒有③:$\rm 2\textit{c}\left( Mn^{2+}\right)+\textit{c}\left( MnOH^{+}\right)+\textit{c}\left( \text{H}^{+}\right)+\textit{c}\left( \text{K}^{+}\right)=2\textit{c}\left( SO_{4}^{2-}\right)+\textit{c}\left( OH^{-}\right)$,将①和②代入③得到:$\rm \textit{c}\left( \text{H}^{+}\right)+\textit{c}\left( \text{K}^{+}\right)=\textit{c}\left( Mn^{2+}\right)+\textit{c}\left( OH^{-}\right)$,此时$\rm pH=10.2$,显碱性,则$\rm \textit{c}\left( Mn^{2+}\right)\lt\textit{c}\left( \text{K}^{+}\right)$,$\rm B$正确;
$\rm C$.图中$\rm O$点存在平衡:$\rm M{{n}^{2+}}+O{{H}^{-}}\rightleftharpoons MnO{{H}^{+}}$,在$\rm \operatorname{P}$点时$\rm \textit{c}\left( Mn^{2+}\right)=\textit{c}\left( MnOH^{+}\right)$,$\rm \text{pH=10}\text{.2}$,$\rm \textit{K}=\dfrac{\textit{c}\left( MnOH^{+}\right)}{\textit{c}\left( Mn^{2+}\right)\cdot\textit{c}\left( OH^{-}\right)}=\dfrac{1}{\textit{c}\left( OH^{-}\right)}=\dfrac{\textit{c}\left( \text{H}^{+}\right)}{\textit{K}_{\text{W}}}=\dfrac{10^{-10.2}}{10^{-14}}=10^{-3.8}$,$\rm O$点$\delta\left( Mn^{2+}\right)=0.6$时,$\rm \delta\left( MnOH^{+}\right)=0.4$,则$\rm \textit{c}\left( O{{H}^{-}} \right)=\dfrac{0.4}{0.6}\times {{10}^{-3.8}}=\dfrac{2}{3}\times {{10}^{-3.8}}\;\rm mol/\text{L}$,则$\rm \rm\textit{c}\left( {{\text{H}}^{+}} \right)=\dfrac{3}{2}\times {{10}^{-10.2}}\;\rm mol/\text{L}$,$\rm C$错误;
$\rm D$.$\rm \operatorname{Q}$点时,物料守恒:$\rm \textit{n}\left( SO_{4}^{2-}\right)=\textit{n}\left( Mn^{2+}\right)+\textit{n}\left[ Mn\left( OH\right)_{2}\right]+\textit{n}\left( MnOH^{+}\right)+\textit{n}\left( MnO_{2}^{2-}\right)+\textit{n}\left( HMnO_{2}^{-}\right)+\textit{n}\left[ Mn\left( OH\right)_{4}^{2-}\right]$,且$\rm \textit{n}\left( MnOH^{+}\right)=\textit{n}\left( HMnO_{2}^{-}\right)$,$\rm \textit{n}\left( MnO_{2}^{2-}\right)=\textit{n}\left[ Mn\left( OH\right)_{4}^{2-}\right]$,则$\rm \textit{n}\left( SO_{4}^{2-}\right)=\textit{n}\left( Mn^{2+}\right)+\textit{n}\left[ Mn\left( OH\right)_{2}\right]+2\textit{n}\left( MnOH^{+}\right)+2\textit{n}\left( MnO_{2}^{2-}\right)$,所以则$\rm \textit{n}\left( SO_{4}^{2-}\right)\gt2\textit{n}\left( MnOH^{+}\right)+2\textit{n}\left( MnO_{2}^{2-}\right)$,即$\rm \textit{c}\left( \text{SO}_{4}^{2-}\right)\gt2 \textit{c}\left( \text{MnO}\text{H}^{+}\right)+2 \textit{c}\left( \text{MnO}_{2}^{2-}\right)$,$\rm D$正确;
故选:$\rm C$
高中 | 化学平衡常数题目答案及解析(完整版)
