高中 | 电离平衡常数 题目答案及解析
稿件来源:高途
高中 | 电离平衡常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第一节 弱电解质的电离
电离平衡常数
不对称催化剂催化$\rm 2-$乙酰氨基$\rm -3-$苯基烯酸乙酯$\rm ($记为$\rm X)$不对称氢化的机理如图所示。平衡时,${n}\left[ \text{XM}\left( \text{R}\right)\right]{/n}\left[ \text{XM}\left( \text{S}\right)\right]\text{=0}\text{.05}$,${n}\left[ \text{X}{{\text{H}}_{\text{2}}}\left( \text{R} \right) \right]{/n}\left[ \text{X}{{\text{H}}_{\text{2}}}\left( \text{S} \right) \right]\text{=40}\text{.0}\rm ($已知:$\rm XM$生成$\rm XH_{2}$的反应为基元反应;$k_{1}$、$k_{2}$为速率常数,$K_{1}$、$K_{2}$为平衡常数$\rm )$。
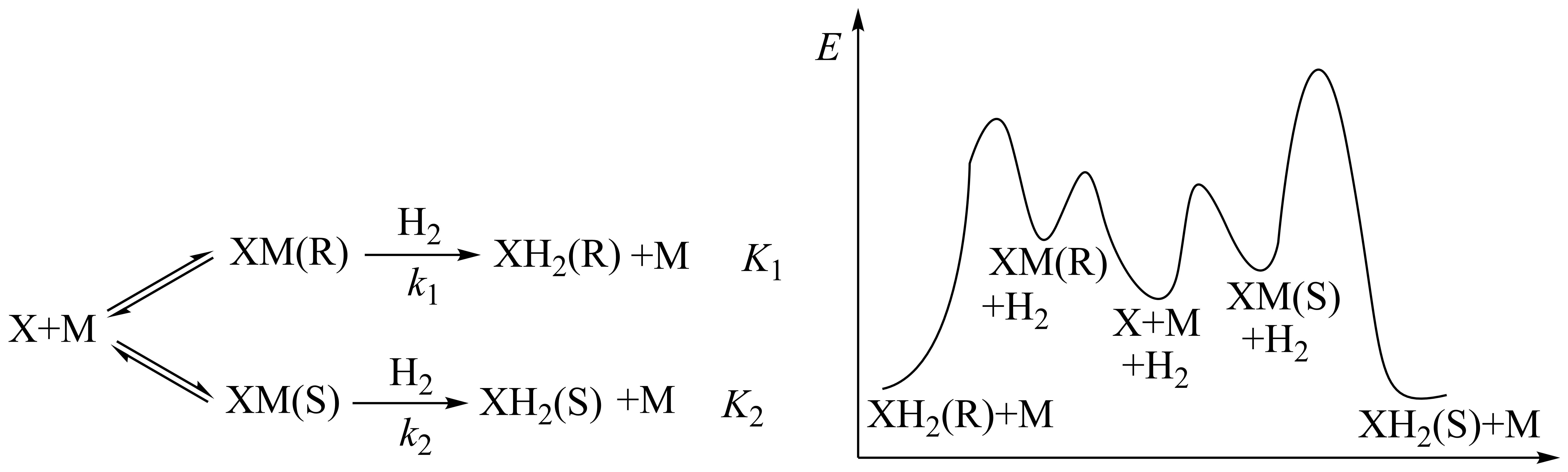
下列说法正确的是$(\qquad)$
平衡常数$K_{2}:K_{1}=800$
","升高温度,$k_{1}/k_{2}$减小
","其他条件不变,增加$\\rm M$的物质的量,$\\rm X$的平衡转化率增大
","已知存在$\\rm XM(R)⇌XM(S)$,提高$\\rm H_{2}$的压强,平衡时,$\\rm \\textit{n}[XH_{2}(R)]/\\textit{n}[XH_{2}(S)]$不变
"]$\rm A$.平衡常数$K_{2}:K_{1}=\dfrac{c\left( \text{M}\right)\times c\left[ \text{X}\text{H}_{2}\left( \text{S}\right)\right]}{c\left( \text{H}_{2}\right)\times c\left[ \text{XM}\left( \text{S}\right)\right]}:\dfrac{c\left( \text{M}\right)\times c\left[ \text{X}\text{H}_{2}\left( \text{R}\right)\right]}{c\left( \text{H}_{2}\right)\times c\left[ \text{XM}\left( \text{R}\right)\right]}=\dfrac{c\left[ \text{X}\text{H}_{2}\left( \text{S}\right)\right]\times c\left[ \text{XM}\left( \text{R}\right)\right]}{c\left[ \text{XM}\left( \text{S}\right)\right]\times c\left[ \text{X}\text{H}_{2}\left( \text{R}\right)\right]}=\dfrac{1}{800}$,$\rm A$错误;
$\rm B$.升高温度,$k_{1}$、$k_{2}$均增大,反应$\rm 2$的活化能大,温度对$k_{2}$的影响大,升高温度$k_{2}$增加的多,$k_{1}/k_{2}$减小,$\rm B$正确;
$\rm C$.$\rm M$是催化剂,反应前后不变,改变催化剂的量,对平衡转化率无影响,$\rm C$错误;
$\rm D$.反应中$\rm XM(R)⇌XM(S)$,反应物和生成物都没有$\rm H_{2}$,增加氢气的量,对平衡无影响,提高$\rm H_{2}$的压强,平衡时,$\rm \textit{n}[XH_{2}(R)]/\textit{n}[XH_{2}(S)]$不变,$\rm D$正确;
故选:$\rm BD$
高中 | 电离平衡常数题目答案及解析(完整版)
