高中 | 电离平衡常数 题目答案及解析
稿件来源:高途
高中 | 电离平衡常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第一节 弱电解质的电离
电离平衡常数
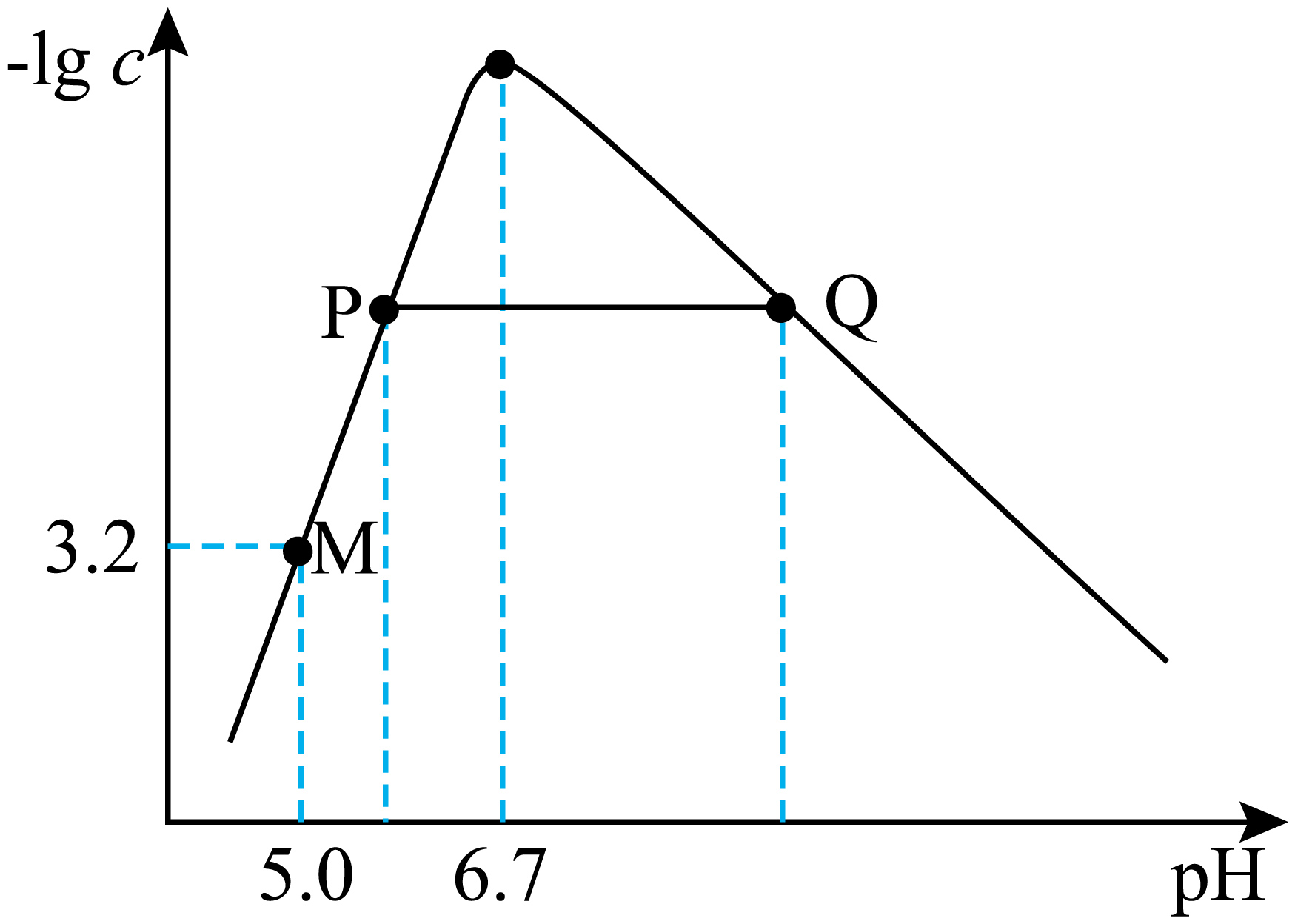
$\text{Cr}{{\left( \text{OH} \right)}_{3}}$是两性氢氧化物,其沉淀分离的关键是控制溶液$\rm pH$。$\rm 25\;\rm ^\circ\rm C$时,某溶液中$ {c}\left( \text{C}{{\text{r}}^{3+}} \right)$与$c\left( {{\left[ \text{Cr}{{\left( \text{OH} \right)}_{4}} \right]}^{-}} \right)$的总和为$c$。$ - \lg c$随$\rm pH$的变化关系如图所示(忽略体积变化)。
已知:
${\rm {Cr}{{\left(\rm {OH} \right)}_{3}}\left(\rm {s} \right)\rightleftharpoons {C}{{{r}}^{3+}}\left(\rm {aq} \right)+3{O}{{{H}}^{-}}\left(\rm {aq} \right)}\qquad{{{K}}_{{\rm sp}}}$
${\rm {Cr}{{\left(\rm {OH} \right)}_{{3}}}\left(\rm {s} \right){+O}{{{H}}^{-}}\left(\rm {aq} \right)\rightleftharpoons {{\left[ {Cr}{{\left(\rm {OH} \right)}_{{4}}} \right]}^{-}}\left(\rm {aq} \right)}\qquad{K}={{10}^{-0.4}}$
下列叙述正确的是$(\qquad)$
由$\\rm M$点可以计算${{{K}}_{{\\rm sp}}}={{10}^{-30.2}}$
","$\\rm {C}{{{r}}^{3+}}$恰好沉淀完全时$\\rm pH$为$\\rm 6.7$
","$\\rm P$点沉淀质量小于$\\rm Q$点沉淀质量
","随$\\rm pH$增大$\\dfrac{{c}\\left(\\rm {C}{{{r}}^{3+}} \\right)}{{c}\\left(\\rm {{[{ Cr}{{\\left(\\rm {OH} \\right)}_{{4}}}]}^{-}} \\right)}$先减小后增大
"]${c}\left(\rm {C}{{{r}}^{3+}} \right)$与$c\left(\rm {{\left[ {Cr}{{\left(\rm {OH} \right)}_{4}} \right]}^{-}} \right)$的总和为$c$,随着$\rm pH$增大,发生反应:$\rm {C}{{{r}}^{3+}}\left(\rm {aq} \right)+3{O}{{{H}}^{-}}\left(\rm {aq} \right)\rightleftharpoons {Cr}{{\left(\rm {OH} \right)}_{3}}\left(\rm {s} \right)$,含铬微粒总浓度下降,随着$\rm pH$继续增大,发生反应 :$\rm {Cr}{{\left(\rm {OH} \right)}_{{3}}}\left(\rm {s} \right){+O}{{{H}}^{-}}\left(\rm {aq} \right)\rightleftharpoons {{\left[ {Cr}{{\left(\rm {OH} \right)}_{{4}}} \right]}^{-}}\left(\rm {aq} \right)$含铬微粒总浓度上升,据此解答。
$\rm A$.$\rm M$点时,${c}\left(\rm O{{H}^{-}} \right)=\dfrac{{{10}^{-14}}}{{{10}^{-5}}}={{10}^{-9}}\;\rm mol/{L}$,${K}=\dfrac{{c}\left(\rm {{\left[ {Cr}{{\left(\rm {OH} \right)}_{4}} \right]}^{-}} \right)}{{c}\left(\rm O{{H}^{-}} \right)}={{10}^{-0.4}}$,${c}\left(\rm {{\left[ {Cr}{{\left(\rm {OH} \right)}_{4}} \right]}^{-}} \right)={{10}^{-9.4}}\;\rm mol/{L}$,几乎可以忽略不计,含$\rm Cr$微粒主要为$\rm C{{r}^{3+}}$,${{{K}}_{\rm sp}}={c}\left(\rm C{{r}^{3+}} \right)\cdot {{{c}}^{3}}\left(\rm O{{H}^{-}} \right)={{10}^{-3.2}}\times {{\left(\rm \dfrac{{{10}^{-14}}}{{{10}^{-5}}} \right)}^{3}}={{10}^{-30.2}}$,$\rm A$正确;
$\rm B$.$\rm {C}{{{r}}^{3+}}$恰好完全沉淀时,${c}\left(\rm C{{r}^{3+}} \right)\lt {{10}^{-5}}\;\rm mol/{L}$,由${{{K}}_{\rm sp}}$数据计算可知,${c}\left(\rm O{{H}^{-}} \right)\gt \sqrt[3]{\dfrac{{{10}^{-30.2}}}{{{10}^{-5}}}}={{10}^{-8.4}}$,$\rm {C}{{{r}}^{3+}}$恰好完全沉淀$\rm pH$最小值$\rm 5.6$,$\rm B$错误;
$\rm C$.$\rm P$和$\rm Q$点溶液中含$\rm Cr$微粒总和相等,生成的$\rm {Cr}{{\left(\rm {OH} \right)}_{3}}\left(\rm {s} \right)$质量相等,则$\rm P$点沉淀质量等于$\rm Q$点沉淀质量,$\rm C$错误;
$\rm D$.随着$\rm pH$的增大,${c}\left(\rm C{{r}^{3+}} \right)$减小,而$c{{\left[\rm {Cr}{{\left(\rm {OH} \right)}_{4}} \right]}^{-}}$增大,$\dfrac{{c}\left(\rm {C}{{{r}}^{3+}} \right)}{{c}\left(\rm {Cr}\left(\rm {OH} \right)_{4}^{-} \right)}$比值减小,$\rm D$错误。
故选:$\rm A$
高中 | 电离平衡常数题目答案及解析(完整版)
