高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
利用“氧化法测定葡萄酒中$\rm SO_{2}$的实验装置如图所示$\rm ($夹持装置略$\rm )$。实验过程如下:
①加样:向梨形瓶$\rm C$和试管$\rm D$中分别加入$\rm 20.0\;\rm mL$和$\rm 5.0\;\rm mL$的$\rm 0.3\%\ H_{2}O_{2}$溶液,并各滴$\rm 3$滴混合指示剂后,溶液立即变为紫色,再依次滴入少量$\rm NaOH$标准液,使$\rm C$和$\rm D$中溶液颜色恰好变为橄榄绿色。向$\rm A$瓶中加入$\rm 20.00\;\rm mL$葡萄酒样品。
②氧化:取$\rm 10.00\;\rm mL\;\rm 25\%$的磷酸溶液加入$\rm A$瓶中,$\rm B$管中缓缓通入$\rm N_{2}\ 10\;\rm min$左右,$\rm C$瓶中溶液颜色逐渐变为紫色,$\rm D$中溶液颜色无变化。
③滴定:取下$\rm C$瓶,用$\rm NaOH$标准液滴定至终点,消耗$\rm NaOH$标准液$V\rm\ mL$。
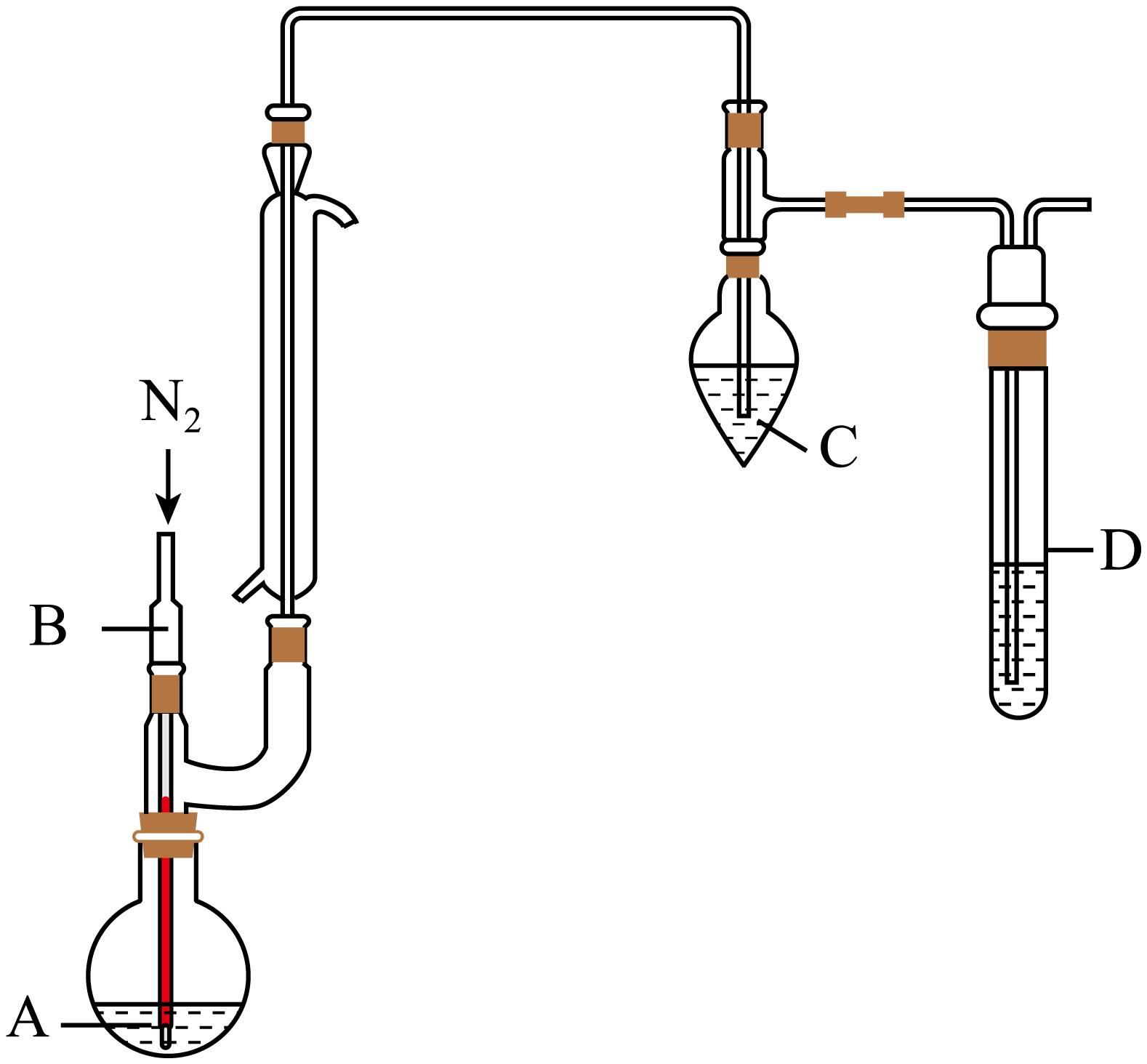
回答下列问题:
仪器$\rm A$的名称为 ,$\rm B$管中通入$\rm N_{2}$的目的是 。
圆底烧瓶 ; 驱赶$\\rm SO_{2}$到$\\rm C$瓶溶液中进行充分反应,同时防止空气中的氧气将葡萄酒中的$\\rm +4$价硫被氧化
"]]由题干实验装置图可知,仪器$\rm A$的名称为圆底烧瓶,结合分析可知$\rm B$管中通入$\rm N_{2}$的目的是驱赶$\rm SO_{2}$到$\rm C$瓶溶液中进行充分反应,同时防止空气中的氧气将葡萄酒中的$\rm +4$价硫被氧化
用$\rm NaOH$固体配制$\rm 100\;\rm mL$ $\rm 0.01\;\rm mol·L^{-1}\ NaOH$溶液,取$\rm 50.00\;\rm mL$该溶液稀释至$\rm 500\;\rm mL$,作为$\rm NaOH$标准液。上述操作过程中必须用到的标有刻度和温度的玻璃仪器为 $\rm ($填标号$\rm )$。
①玻璃棒 ②胶头滴管 ③$\rm 100\;\rm mL$容量瓶 ④$\rm 500\;\rm mL$容量瓶
③④
"]]用$\rm NaOH$固体配制$\rm 100\;\rm mL$ $\rm 0.01\;\rm mol·L^{-1}\ NaOH$溶液中需要使用的仪器有:天平、烧杯、玻璃棒、$\rm 100\;\rm mL$容量瓶和胶头滴管,取$\rm 50.00\;\rm mL$该溶液稀释至$\rm 500\;\rm mL$需要使用的仪器有:量筒、烧杯、玻璃棒、$\rm 500\;\rm mL$容量瓶和胶头滴管,其中量筒、容量瓶中必须标明刻度和温度,即上述操作过程中必须用到的标有刻度和温度的玻璃仪器为$\rm 100\;\rm mL$容量瓶、$\rm 500\;\rm mL$容量瓶
“氧化”过程,梨形瓶$\rm C$中发生反应的离子方程式为 。
$\\rm SO_{2}+H_{2}O_{2}=2H^{+}+\\text{SO}_{\\text{4}}^{\\text{2-}}$或者$\\rm SO_{2}+H_{2}O_{2}+2OH^{-}=2H_{2}O+\\text{SO}_{\\text{4}}^{\\text{2-}}$
"]]由分析可知,“氧化”过程,梨形瓶$\rm C$中发生氧化反应生成$\rm H_{2}SO_{4}$,方程式为:$\rm H_{2}O_{2}+SO_{2}=H_{2}SO_{4}$,则该反应的离子方程式为:$\rm SO_{2}+H_{2}O_{2}=2H^{+}+\text{SO}_{\text{4}}^{\text{2-}}$或者$\rm SO_{2}+H_{2}O_{2}+2OH^{-}=2H_{2}O+\text{SO}_{\text{4}}^{\text{2-}}$
该滴定实验达到终点现象为 ,样品中$\rm SO_{2}$的含量为 $\rm \;\rm g/L$。
滴入最后半滴$\\rm NaOH$溶液,溶液由紫色变为橄榄绿色,且$\\rm 30\\ s$不变色 ; $1.6V\\times10^{-3}$
"]]由分析可知,该滴定实验达到终点现象为滴入最后半滴$\rm NaOH$溶液,溶液由紫色变为橄榄绿色,且$\rm 30\ s$不变色,由$(2)$可知,$\rm NaOH$标准液的浓度为:$\rm 0.001\;\rm mol/L$,根据题干信息可知,$\rm SO_{2}$~$\rm H_{2}SO_{4}$~$\rm 2NaOH$,故$n\rm(SO_{2})=\dfrac{\text{1}}{\text{2}}\textit{n}(NaOH)\rm =\dfrac{1}{2}\rm \times 0.001\;\rm mol/L\times \textit{V}\times 10^{-3}\;\rm L=5.0\textit{V}\times 10^{-7}\;\rm mol$,则样品中$\rm SO_{2}$的含量为:$\dfrac{\text{5.0}\textit{V }\!\!\times\!\!\text{ 1}{{\text{0}}^{\text{-7}}}\ \text{mol }\!\!\times\!\!\text{ 64\ g/mol}}{\text{20}\text{.00 }\!\!\times\!\!\text{ 1}{{\text{0}}^{\text{-3}}}\ \text{L}}\rm =1.6\textit{V}\times 10^{-3}\;\rm g/L$
装置$\rm D$的作用为 ;若试管 $\rm D$中溶液颜色发生变化,其它操作不变,测定结果会 $\rm ($填“偏大”“偏小”或“不变”$\rm )$。
验证$\\rm SO_{2}$全部被$\\rm C$瓶中的$\\rm H_{2}O_{2}$氧化 ; 偏小
"]]由题干信息可知,装置$\rm D$中溶液颜色没有发生改变,说明从$\rm C$中逸出的气体中不含$\rm SO_{2}$,故装置$\rm D$的作用为验证$\rm SO_{2}$全部被$\rm C$瓶中的$\rm H_{2}O_{2}$氧化,若试管 $\rm D$中溶液颜色发生变化,说明$\rm SO_{2}$未完全被$\rm C$中$\rm H_{2}O_{2}$氧化,则生成的硫酸物质的量偏小,消耗标准液$\rm NaOH$的体积偏小,则其它操作不变,测定结果会偏小
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
