高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
无水$\text{CrC}{{\text{l}}_{3}}$易水解,$650\;\rm ^\circ\rm C$以上升华,常用于有机合成。设计以下实验制无水$\text{CrC}{{\text{l}}_{3}}$并测定产品纯度。回答下列问题。
Ⅰ.制备$\text{CrC}{{\text{l}}_{3}}\cdot 6{{\text{H}}_{2}}\text{O}$
${{\text{K}}_{2}}\text{C}{{\text{r}}_{2}}{{\text{O}}_{7}}$与浓盐酸在加热条件下制备$\text{CrC}{{\text{l}}_{3}}$,反应后经一系列操作得$\text{CrC}{{\text{l}}_{3}}\cdot 6{{\text{H}}_{2}}\text{O}$。
${{\text{K}}_{2}}\text{C}{{\text{r}}_{2}}{{\text{O}}_{7}}$与浓盐酸反应的离子方程式为 。
$\\text{C}{{\\text{r}}_{2}}\\text{O}_{7}^{2-}+14{{\\text{H}}^{+}}+6\\text{C}{{\\text{l}}^{-}}=2\\text{C}{{\\text{r}}^{3+}}+3\\text{C}{{\\text{l}}_{2}}\\uparrow +7{{\\text{H}}_{2}}\\text{O}$
"]]$\rm \text{K}_{2}Cr_{2}\text{O}_{7}$中$\rm Cr$为$\rm +7$价,浓盐酸中$\rm Cl$为$\rm -1$价,两者发生氧化还原反应,故离子方程式为:$\rm C{{r}_{2}}\text{O}_{7}^{2-}\rm +14{{\text{H}}^{+}}+6C{{l}^{-}}=2C{{r}^{3+}}+3C{{l}_{2}}\uparrow +7{{\text{H}}_{2}}\text{O}$;
Ⅱ.制备无水$\text{CrC}{{\text{l}}_{3}}$
$\text{CrC}{{\text{l}}_{3}}\cdot 6{{\text{H}}_{2}}\text{O}$与$\text{SOC}{{\text{l}}_{2}}$蒸气加热反应制$\text{CrC}{{\text{l}}_{3}}$装置如图$\rm ($夹持及部分加热装置省略$\rm )$。$\text{SOC}{{\text{l}}_{2}}$沸点$76\;\rm ^\circ\rm C$,遇水极易反应。
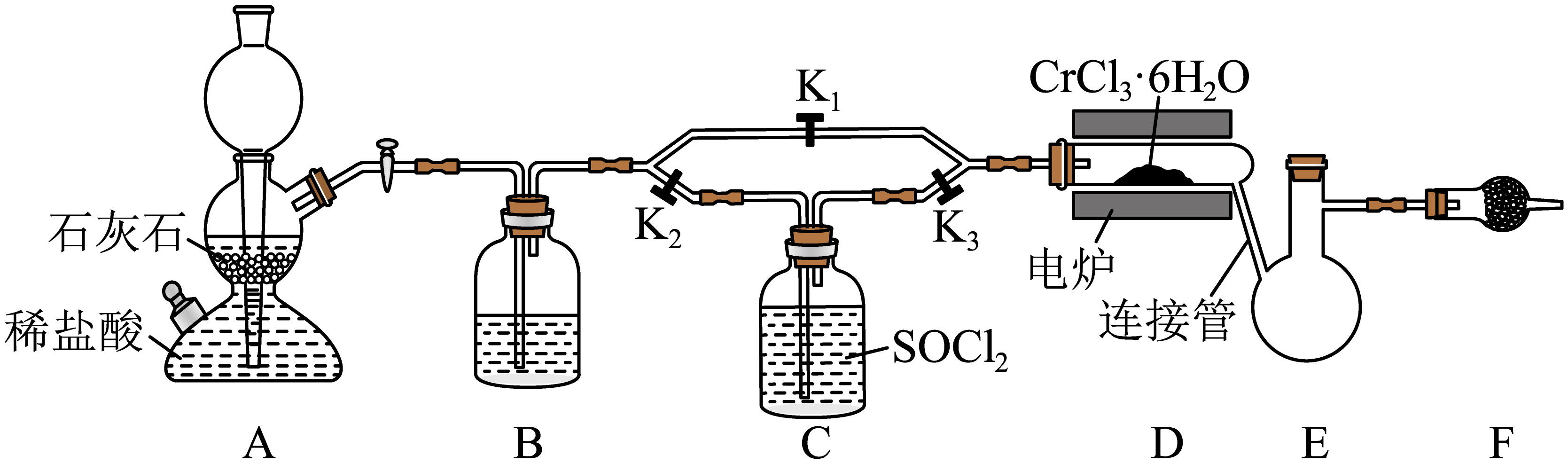
$\rm B$中盛放的试剂为 。装置$\rm F$中盛放碱石灰,作用为 。
浓硫酸; 吸收$\\text{S}{{\\text{O}}_{2}}$和$\\text{HCl}$,防止污染空气防止空气中的水蒸气进入装置
"]]由图可知,装置$\rm A$产生$\text{C}{{\text{O}}_{2}}$,排尽装置中的空气,由于$\text{SOC}{{\text{l}}_{2}}$沸点$76\;\rm ^\circ\rm C$,遇水极易反应,故装置$\rm B$盛放的应为浓硫酸,用于干燥$\text{C}{{\text{O}}_{2}}$;由于$\text{CrC}{{\text{l}}_{3}}\cdot 6{{\text{H}}_{2}}\text{O}$与$\text{SOC}{{\text{l}}_{2}}$蒸气加热反应制$\text{CrC}{{\text{l}}_{3}}$反应为:$\text{CrC}\text{l}_{3}\cdot6\text{H}_{2}\text{O+6SOC}\text{l}_{\text{2}}\begin{matrix}\underline{\underline{高温 }}\\\\\end{matrix}\text{CrC}\text{l}_{\text{3}}\text{+6S}\text{O}_{\text{2}}\text{+12HCl}$,会产生$\text{S}{{\text{O}}_{2}}$和$\text{HCl}$,污染空气,故装置$\rm F$中盛放碱石灰,作用为:吸收$\text{S}{{\text{O}}_{2}}$和$\text{HCl}$,防止污染空气并防止空气中的水蒸气进入装置;
装置$\rm D$中反应的化学方程式为 。
$\\text{CrC}\\text{l}_{3}\\cdot6\\text{H}_{2}\\text{O+6SOC}\\text{l}_{\\text{2}}\\begin{matrix}\\underline{\\underline{ 高温}}\\\\\\\\\\end{matrix}\\text{CrC}\\text{l}_{\\text{3}}\\text{+6S}\\text{O}_{\\text{2}}\\text{+12HCl}$
"]]装置$\rm D$中反应的化学方程式为:$\text{CrC}\text{l}_{3}\cdot6\text{H}_{2}\text{O+6SOC}\text{l}_{\text{2}}\begin{matrix}\underline{\underline{ 高温}}\\\\\end{matrix}\text{CrC}\text{l}_{\text{3}}\text{+6S}\text{O}_{\text{2}}\text{+12HCl}$;
实验开始时,通入$\text{C}{{\text{O}}_{2}}$排出装置内空气后,再 $\rm ($填控制止水夹的操作$\rm )$,将$\text{SOC}{{\text{l}}_{2}}$带入装置$\text{D}$。
关闭${{\\text{K}}_{1}}$,打开${{\\text{K}}_{2}}$、$\\ {{\\text{K}}_{3}}$
"]]实验开始时,通入$\text{C}{{\text{O}}_{2}}$排出装置内空气后,再关闭${{\text{K}}_{1}}$,打开${{\text{K}}_{2}}$、${{\text{K}}_{3}}$,利用$\text{C}{{\text{O}}_{2}}$流经$\rm C$瓶将$\text{SOC}{{\text{l}}_{2}}$蒸汽带入装置$\text{D}$;
实验过程中,连接管需间歇性加热,其目的是 。
防止$\\text{CrC}{{\\text{l}}_{3}}$冷却凝固堵塞连接管
"]]由于无水$\text{CrC}{{\text{l}}_{3}}$易水解,$650\;\rm ^\circ\rm C$以上升华,故实验过程中,连接管需间歇性加热,其目的是为了防止$\text{CrC}{{\text{l}}_{3}}$冷却凝固堵塞连接管;
Ⅲ.测定无水$\text{CrC}{{\text{l}}_{3}}$的纯度
①称取制备的无水$\text{CrC}{{\text{l}}_{3}}\ 1.000\ \text{g}$,溶于水后定容至$100\ \text{mL}$。
②取$25.00\ \text{mL}$溶液于碘量瓶中,加入稍过量的$\text{N}{{\text{a}}_{2}}{{\text{O}}_{2}}$充分反应,再加入${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$将$\text{C}{{\text{r}}^{3+}}$转化为$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$;煮沸、冷却后再加入过量$\text{KI}$固体,加塞摇匀。
③加入少量淀粉溶液,再用$0.1000\;\rm \text{mol}/\text{L}$的$\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}$标准溶液滴定,平行滴定三次,平均消耗$\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}$溶液$30.00\ \text{mL}$。
已知:$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}+{{\text{I}}^{-}}+{{\text{H}}^{+}}\to {{\text{I}}_{\text{2}}}\text{+C}{{\text{r}}^{\text{3+}}}+{{\text{H}}_{\text{2}}}\text{O}\rm ($未配平$\rm )$;${{\text{I}}_{\text{2}}}+{{\text{S}}_{\text{2}}}\text{O}_{\text{3}}^{\text{2-}}\to {{\text{S}}_{\text{4}}}\text{O}_{\text{6}}^{\text{2-}}+{{\text{I}}^{-}}\rm ($未配平$\rm )$。
样品中无水$\text{CrC}{{\text{l}}_{3}}$的质量分数为 。若步骤②中未煮沸,则测得的无水$\text{CrC}{{\text{l}}_{3}}$的质量分数 $\rm ($填“偏高”“偏低”或“无影响”$\rm )$。
$\\rm 63.40\\%$ ;偏高
"]]①滴定反应相应离子方程式为:$\rm C{{r}_{2}}\text{O}_{7}^{2-}\rm +6{{\text{I}}^{-}}+14{{\text{H}}^{+}}=2C{{r}^{3+}}+3{{\text{I}}_{2}}+7{{\text{H}}_{2}}\text{O}$,${{\text{I}}_{2}}\rm +2{{\text{S}}_{2}}\text{O}_{3}^{2-}\rm =2{{\text{I}}^{-}}\rm +{{\text{S}}_{4}}\text{O}_{6}^{2-}$,$\rm 2\text{C}{{\text{r}}^{\text{3}}}^{+}\rm \sim 3{{\text{I}}_{\text{2}}}\rm \sim 6\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}$,故$3n(\text{CrC}{{\text{l}}_{3}}\rm )=\textit{n}(\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}\rm )$,故无水$\text{CrC}{{\text{l}}_{3}}$的质量分数为$\dfrac{0.1000\;\rm mol/\text{L}\times 30.00\;\rm m\text{L}\times {{10}^{-3}}\times 4\times \dfrac{1}{3}\times 158.5\ \text{g}/mol}{1.000\ \text{g}}\times 100\%=63.40\%$;
②步骤②取$25.00\ \text{mL}$溶液于碘量瓶中,加入稍过量的$\text{N}{{\text{a}}_{2}}{{\text{O}}_{2}}$充分反应,再加入${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$将$\text{C}{{\text{r}}^{3+}}$转化为$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$;煮沸、冷却后再加入过量$\text{KI}$固体,煮沸是为了除去${{\text{H}}_{\text{2}}}{{\text{O}}_{2}}$,若不煮沸,${{\text{H}}_{\text{2}}}{{\text{O}}_{2}}$也会将${{\text{I}}^{-}}$氧化为${{\text{I}}_{\text{2}}}$,则消耗的$\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}$多,故测得的无水$\text{CrC}{{\text{l}}_{3}}$的质量分数偏高。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
