高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
一氧化碳是合成气和各类煤气的主要成分,是有机化工的重要原料,也可用作燃料及精炼金属的还原剂。回答下列问题:
$\rm CO$与${{\text{H}}_{2}}$、${{\text{O}}_{2}}$可以合成乙二醇,反应为$2\text{CO}+{{\text{O}}_{2}}+5{{\text{H}}_{2}}=\text{HOC}{{\text{H}}_{2}}\text{C}{{\text{H}}_{2}}\text{OH}+2{{\text{H}}_{2}}\text{O}$。
已知:$\text{CO}\left( \text{g} \right)$、${{\text{H}}_{2}}\left( \text{g} \right)$、乙二醇$\rm (l)$的燃烧热$\Delta H$分别为$-283.0\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$、$-285.8\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$、$-1118.8\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
则反应$2\text{CO}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)+5{{\text{H}}_{2}}\left( \text{g} \right)=\text{HOC}{{\text{H}}_{2}}\text{C}{{\text{H}}_{2}}\text{OH}\left( \rm l \right)+2{{\text{H}}_{2}}\text{O}\left( \rm l \right)$的$\Delta H=$ 。
$-876.2\\;\\rm \\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$
"]]根据①$\text{CO}(\text{g})+\dfrac{1}{2}{{\text{O}}_{2}}(\text{g})=\text{C}{{\text{O}}_{2}}(\text{g})\qquad\Delta {{ {H}}_{1}}=-283.0\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
②${{\text{H}}_{2}}(\text{g})+\dfrac{1}{2}{{\text{O}}_{2}}(\text{g})={{\text{H}}_{2}}\text{O}(\text{l})\qquad\Delta {{ {H}}_{2}}=-285.8\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
③$\text{HOC}{{\text{H}}_{2}}\text{C}{{\text{H}}_{2}}\text{OH}{(\rm l)}+\dfrac{5}{2}{{\text{O}}_{2}}(\text{g})=2\text{C}{{\text{O}}_{2}}(\text{g})+3{{\text{H}}_{2}}\text{O}(\text{l})\qquad\Delta {{ {H}}_{3}}=-1118.8\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
根据盖斯定律:$\rm 2\times $①$\rm +5\times $②$\rm -$③得到:$2\text{CO}(\text{g})+{{\text{O}}_{2}}(\text{g})+5{{\text{H}}_{2}}(\text{g})=\text{HOC}{{\text{H}}_{2}}\text{C}{{\text{H}}_{2}}\text{OH}(\rm l)+2{{\text{H}}_{2}}\text{O}(\text{l})$;
则$\Delta {H}=2\Delta {{ {H}}_{1}}+5\Delta {{ {H}}_{2}}-\Delta {{ {H}}_{3}}=2\times (-283.0)+5\times (-285.8)-(-1118.8)=-876.2\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
工业合成光气的原理为$\text{CO}\left( \text{g} \right)+\text{C}{{\text{l}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{COC}{{\text{l}}_{2}}\left( \text{g} \right)\qquad\Delta H$。一定条件下,在密闭容器中充入$1\text{ mol CO}$与$1\text{ mol C}{{\text{l}}_{2}}$合成$\text{COC}{{\text{l}}_{2}}$,平衡时$\text{CO}$的转化率与温度的倒数$\left( \dfrac{1}{T} \right)$、压强的关系如图所示:
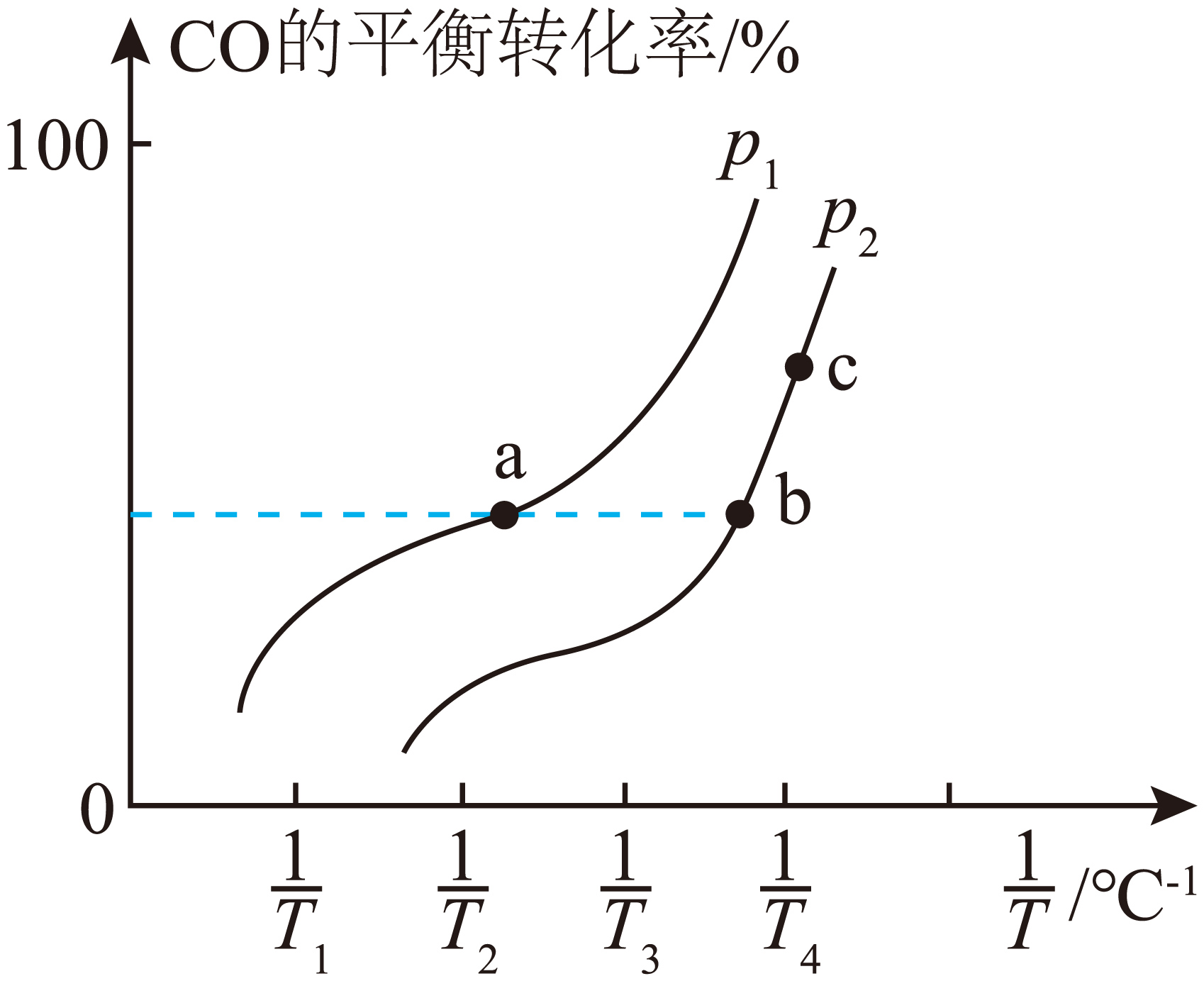
①若该反应的$\Delta H$ $\rm ($填“$\rm \gt $”或“$\rm \lt $”$\rm )0$。
②图示中达到平衡所需要的时间最短的点是 $\rm ($填“$\rm a$点”“$\rm b$点”或“$\rm c$点”$\rm )$。
$\\rm \\lt $;$\\rm a$点
"]]①根据图示可知,温度相同时,${{ {p}}_{1}}$压强下,$\text{CO}$的平衡转化率高,故${{ {p}}_{1}}\gt {{ {p}}_{2}}$,温度越高,平衡时$\text{CO}$的转化率越小,所以反应$\text{CO}\left( \text{g} \right)+\text{C}{{\text{l}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{COC}{{\text{l}}_{2}}\left( \text{g} \right)$的$\Delta { H}\lt 0$;
②$\rm a$点的温度要比$\rm \text{b}$点和$\rm \text{c}$点的高,且压强大,反应速率快,$\rm \text{a}$点达到平衡时间最短;
$\text{C}{{\text{H}}_{4}}-\text{C}{{\text{O}}_{2}}$重整反应可获得合成气$\text{CO}$和${{\text{H}}_{2}}$,主要反应如下:
反应$\rm I$:$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)$
反应$\rm II$:${{\text{H}}_{2}}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$
反应$\rm III$:$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)$
一定温度下,起始时将$1\text{ mol C}{{\text{H}}_{4}}$和$1.4\text{ mol C}{{\text{O}}_{2}}$的混合气体充入某恒容密闭容器中,平衡时测得$n\left( \text{CO} \right)=1.8\;\rm \text{mol}$,$\text{C}{{\text{H}}_{4}}$和${{\text{H}}_{2}}\text{O}$的物质的量分数相等。
①平衡时甲烷的转化率为 。
②若起始压强为$12\;\rm \text{kPa}$,则该温度下反应$\rm II$的平衡常数${{K}_{\text{p}}}=$ $ ({{K}_{\text{p}}}$为用分压表示的平衡常数,分压$\rm =$总压$\times $物质的量分数,结果保留三位有效数字$\rm )$。
$\\rm 80\\%$;$\\rm 0.643$
"]]①设平衡时${n}({\rm C}{{\rm {H}}_{4}})={n}({{\rm {H}}_{2}}{\rm O})={x}\ \rm {mol}$,${n}({{{\rm H}}_{2}})={y}\rm \ {mol}$,${n}({\rm C}{\rm {{O}}_{2}})={z}\ \rm {mol}$,由原子守恒可得:$\rm C$守恒:$1-x+1.4-z=1.8$;$\rm H$守恒:$(1-x) \times 4=2 x+2 y$;$\rm O$守恒:$(1.4-z) \times 2=x+1.8$联解可得,${x}=0.2$、${y}=1.4$、${z}=0.4$,所以平衡时$\rm {C}{{{H}}_{4}}$的转化率为$\dfrac{1-0.2}{1}\times 100\%=80\%$
②平衡时,$0.2 \;\mathrm{mol}$,${n}({{\rm {H}}_{2}}{\rm O})=0.2\;\rm {mol}$,${n}\rm ({{{H}}_{2}})=1.4\;\rm {mol}$,${n}(\rm {C}{{{O}}_{2}})=0.4\;\rm {mol}$,${n}\rm ({CO})=1.8\;\rm {mol}$,反应Ⅱ是气体分子数不变的反应,可用物质的量之比代替分压之比,故反应Ⅱ的$K_{\mathrm{b}}\left(\mathrm{NH}_3 \cdot \mathrm{H}_2 \mathrm{O}\right)=1.8 \times 10^{-5}$;
八羰基二钴$\left[ \text{C}{{\text{o}}_{2}}{{\left( \text{CO} \right)}_{8}} \right]$主要用作有机化合物羰基化反应的催化剂,可由$\text{Co}$与$\text{CO}$在高温高压条件下直接合成。$\text{C}{{\text{o}}_{2}}{{\left( \text{CO} \right)}_{8}}$中碳原子是该配位化合物的配原子,其理由是 。
碳元素的电负性比氧元素小,容易给出孤电子对
"]]$\text{C}{{\text{o}}_{2}}{{\left( \text{CO} \right)}_{8}}$中碳元素的电负性比氧元素小,碳原子容易给出孤电子对形成配位键,是该配位化合物的配原子;
研究人员开发出了不需要将$\text{C}{{\text{O}}_{2}}$溶解在水溶液中,而是通过采用多孔催化剂电极将$\text{C}{{\text{O}}_{2}}$转化为$\text{CO}$的电解池,工作原理如图$\rm 1$所示。为了使$\text{C}{{\text{O}}_{2}}$气体直接发生反应,需要在催化剂层内形成大量的由$\text{C}{{\text{O}}_{2}}\rm ($气体$\rm )$、${{\text{H}}_{2}}\text{O}\rm ($液体$\rm )$、催化剂$\rm ($固体$\rm )$聚集而成的三相界面,如图$\rm 2$所示。
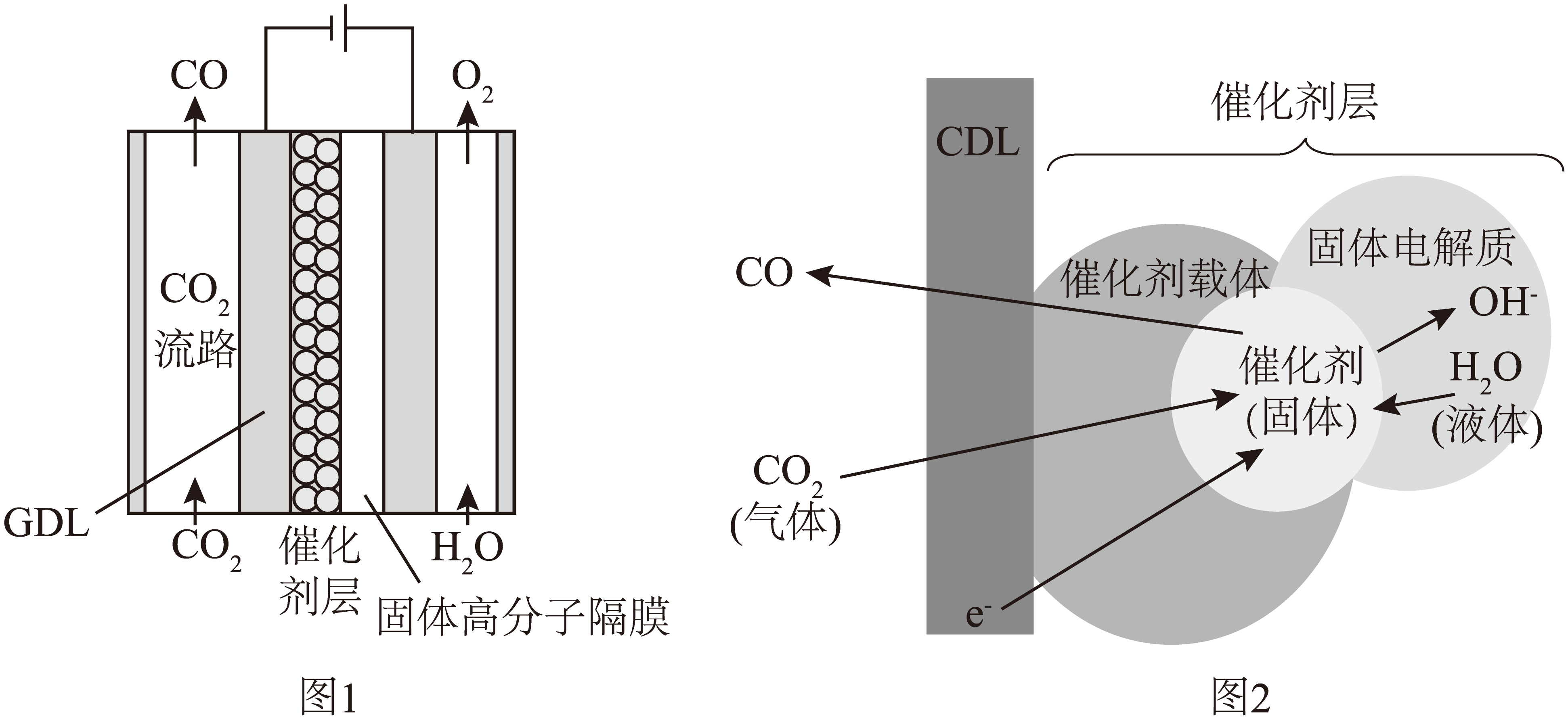
①阴极的电极反应式为 。
②标准状况下,二氧化碳按$22.4\text{ L}\cdot \text{mi}{{\text{n}}^{-1}}$的气流速率通过该装置。电解$20\;\rm \text{min}$后,测得选择性$S\left( \text{CO} \right)=90\%\left[ S\left( \text{CO} \right)=\dfrac{n\left(生成 \text{CO}所用的\text{C}{{\text{O}}_{2}} \right)}{n\left(通过的 \text{C}{{\text{O}}_{2}} \right)}\times 100\% \right]$,理论上产生$\rm CO$的物质的量为 $\rm \;\rm mol$。
$\\text{C}{{\\text{O}}_{2}}+2{{\\text{e}}^{-}}+{{\\text{H}}_{2}}\\text{O}=\\text{CO}+2\\text{O}{{\\text{H}}^{-}}$;$\\rm 18$
"]]①根据图示可知,阴极上二氧化碳得电子被还原为一氧化碳,电极反应式为$\text{C}{{\text{O}}_{2}}+2{{\text{e}}^{-}}+{{\text{H}}_{2}}\text{O}=\text{CO}+2\text{O}{{\text{H}}^{-}}$;
②$22.4\text{ L}\cdot \text{mi}{{\text{n}}^{-1}}$的气流速率通过该装置,电解$20\;\rm \text{min}$,则$\text{C}{{\text{O}}_{2}}$体积为$448\text{ L}$,$S\left( \text{CO} \right)=90\%$,得$448 \;\mathrm{L} \times 0.9=403.2\; \mathrm{L}$,即$18\;\rm \text{mol}$。
高中 | 化学平衡常数题目答案及解析(完整版)
