高中 | 分子的极性 题目答案及解析
稿件来源:高途
高中 | 分子的极性题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第三节 分子的性质
分子的极性
三种氮氧化物的结构如下所示:
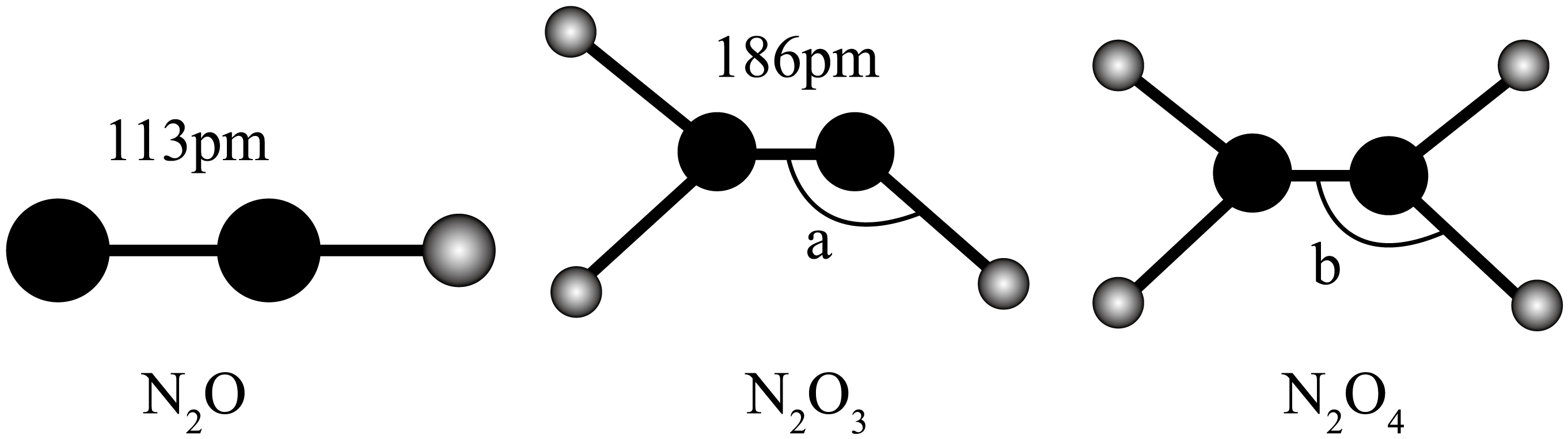
下列说法正确的是$\rm (\qquad)$
氮氮键的键能:$\\rm {{\\text{N}}_{2}}\\text{O}\\gt {{\\text{N}}_{2}}{{\\text{O}}_{3}}$
","熔点:$\\rm {{\\text{N}}_{2}}{{\\text{O}}_{3}}\\gt {{\\text{N}}_{2}}{{\\text{O}}_{4}}$
","分子的极性:$\\rm {{\\text{N}}_{2}}{{\\text{O}}_{4}}\\gt {{\\text{N}}_{2}}\\text{O}$
","$\\rm \\text{N}-\\text{N}-\\text{O}$的键角:$\\rm \\text{a}\\gt \\text{b}$
"]$\rm A$.由图中数据可知,氮氮键的键长:$\rm {{\text{N}}_{2}}\text{O}\lt {{\text{N}}_{2}}{{\text{O}}_{3}}$,则氮氮键的键能:$\rm {{\text{N}}_{2}}\text{O}\gt {{\text{N}}_{2}}{{\text{O}}_{3}}$,$\rm A$正确;
$\rm B$.二者均为分子构成的物质,分子间作用力:$\rm {{\text{N}}_{2}}{{\text{O}}_{3}}\lt {{\text{N}}_{2}}{{\text{O}}_{4}}$,熔点:$\rm {{\text{N}}_{2}}{{\text{O}}_{3}}\lt {{\text{N}}_{2}}{{\text{O}}_{4}}$,$\rm B$错误;
$\rm C$.$\rm {{\text{N}}_{2}}{{\text{O}}_{4}}$为对称的平面结构,极性较弱,而$\rm {{\text{N}}_{2}}\text{O}$结构不对称,正负电荷中心不能重合,属于典型的极性分子,故分子极性:$\rm {{\text{N}}_{2}}{{\text{O}}_{4}}\lt {{\text{N}}_{2}}\text{O}$,$\rm C$错误;
$\rm D$.$\rm {{\text{N}}_{2}}{{\text{O}}_{3}}$结构为$\rm \text{O}=\text{N}-N{{O}_{2}}$,中心原子$\rm N$存在$\rm \dfrac{5-2\times 1-1\times 1}{2}=1$对孤对电子,中心原子$\rm N$为$\rm s{{p}^{2}}$杂化,受孤对电子影响,键角略小于$\rm 120^\circ$;而$\rm {{\text{N}}_{2}}{{\text{O}}_{4}}$中心原子$\rm N$的孤对电子为$\rm \dfrac{5-2\times 2-1\times 1}{2}=0$,价电子数为$\rm 3$,也是$\rm s{{p}^{2}}$杂化,没有孤对电子的影响,故键角$\rm \text{a}\text{b}$,$\rm D$错误。
故选:$\rm A$
高中 | 分子的极性题目答案及解析(完整版)
