高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
某实验小组在实验室进行下列实验:
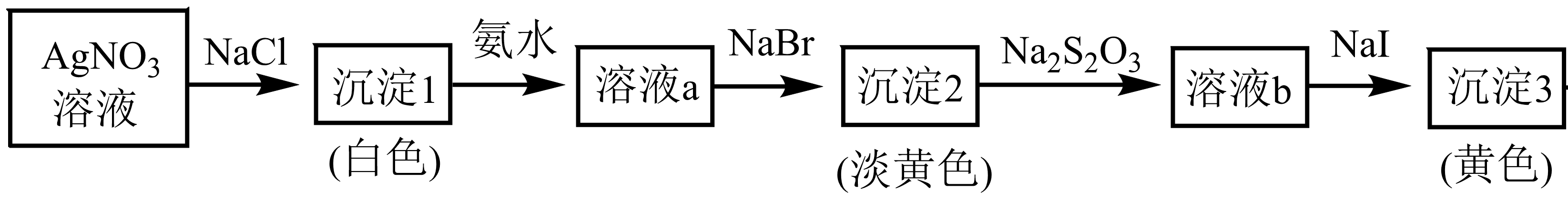
已知:$\rm A{{g}^{+}}$可形成配离子$\rm {{\left[ Ag{{(N{{H}_{3}})}_{2}} \right]}^{+}}$、$\rm {{\left[ Ag{{({{S}_{2}}{{O}_{3}})}_{2}} \right]}^{3-}}$,$ { K_{{\rm sp}}{\rm ({AgCl})}\gt K_{{\rm sp}}{\rm ({AgBr})}\gt K_{{\rm sp}}\rm ({AgI})}$。根据实验现象判断,下列说法正确的是$\rm (\qquad)$
氯化银溶于氨水是因为氨水显碱性
","溶液$\\rm a$的溶质和银氨溶液的溶质相同
","稳定性:$\\rm {{\\left[ Ag{{(N{{H}_{3}})}_{2}} \\right]}^{+}}\\lt {{\\left[ Ag{{({{S}_{2}}{{O}_{3}})}_{2}} \\right]}^{3-}}$
","碘化银不可能转化为溴化银
"]根据流程中的现象变化,向硝酸银溶液中滴加氯化钠,出现白色沉淀,白色沉淀为$\rm AgCl$,再向其中加入氨水,沉淀溶解,生成了可溶盐$\rm [Ag(NH_{3})_{2}]Cl$,再加溴化银,出现淡黄色沉淀,为$\rm AgBr$,再加硫代硫酸钠,沉淀溶解,生成可溶配离子$\rm {{\left[ Ag{{({{S}_{2}}{{O}_{3}})}_{2}} \right]}^{3-}}$,最后加入碘化钠,产生黄色碘化银沉淀。
$\rm A$.氯化银溶于氨水是因为$\rm Ag^{+}$与$\rm NH^{3}$形成了配离子$\rm 1 {\ mol\ }\left[{Ag}\left({NH}_{3}\right)_{2}\right]^{+}$,而不是因为氨水显碱性,$\rm A$错误。
$\rm B$.溶液$\rm a$的溶质主要是$\rm [Ag(NH_{3})_{2}]Cl$,银氨溶液的溶质是$\rm [Ag(NH_{3})_{2}]OH$,溶质不同,$\rm B$错误。
$\rm C$.向含$\rm 1 {\ mol\ }\left[{Ag}\left({NH}_{3}\right)_{2}\right]^{+}$的溶液中加入$\rm NaBr$能生成$\rm AgBr$沉淀,而向含$\rm {{\left[ Ag{{({{S}_{2}}{{O}_{3}})}_{2}} \right]}^{3-}}$的溶液中加入$\rm NaBr$不生成沉淀,说明$\rm 1 {\ mol\ }\left[{Ag}\left({NH}_{3}\right)_{2}\right]^{+}$更容易电离出$\rm Ag+$,即稳定性:$\rm 1 {\ mol\ }\left[{Ag}\left({NH}_{3}\right)_{2}\right]^{+}\lt {{\left[ Ag{{({{S}_{2}}{{O}_{3}})}_{2}} \right]}^{3-}}$,$\rm C$正确。
$\rm D$.虽然${ K_{{\rm sp}}{\rm ({AgCl})}\gt K_{{\rm sp}}{\rm ({AgBr})}\gt K_{{\rm sp}}\rm ({AgI})}$,但在一定条件下,如加入足够浓的$\rm Br^{-}$溶液,碘化银也可能转化为溴化银,$\rm D$错误。
故选:$\rm C$
高中 | 配合物理论题目答案及解析(完整版)
