高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
碳酸锰$\rm (\text{MnC}{{\text{O}}_{3}}\rm )$是制造高性能磁性材料的主要原料,工业上可由天然二氧化锰粉与硫化锰矿$\rm ($还含$\rm Fe$、$\rm Al$、$\rm Zn$、$\rm Ni$、$\rm Si$等元素$\rm )$制备,工艺流程如图所示。
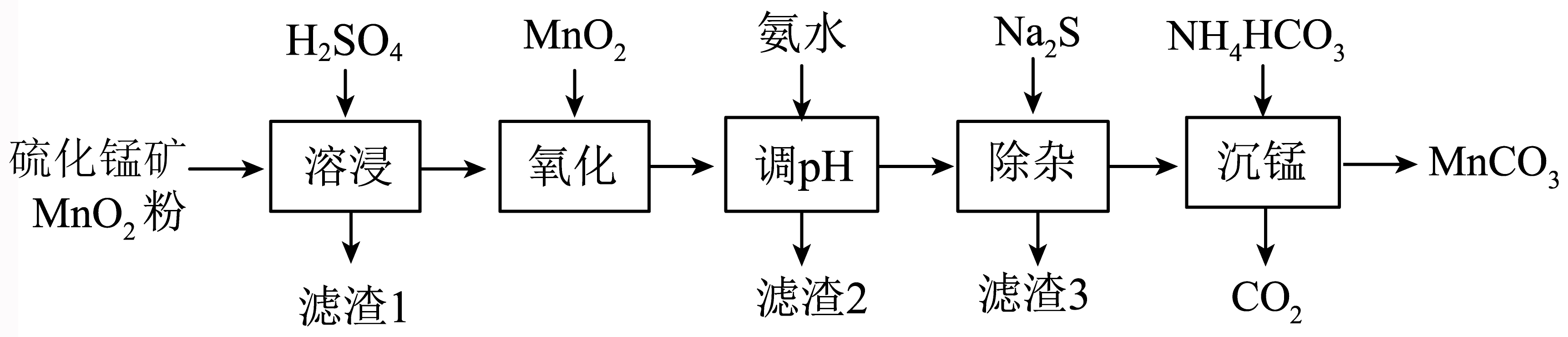
已知:
①$\rm 25\;\rm ^\circ\rm C$时,${{K}_{\text{sp}}}\left( \text{ZnS} \right)=2.9\times {{10}^{-25}}$,${{K}_{\text{sp}}}\left( \text{NiS} \right)=1.0\times {{10}^{-21}}$;
②相关金属离子$ [{{c}_{0}}\left( {{\text{M}}^{ {n}+}} \right)=0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\rm ]$形成氢氧化物沉淀的$\rm pH$范围如表:
| 金属离子${{\text{M}}^{n+}}$ | $\text{A}{{\text{l}}^{3+}}$ | $\text{F}{{\text{e}}^{3+}}$ | $\text{F}{{\text{e}}^{2+}}$ | $\text{Z}{{\text{n}}^{2+}}$ | $\text{N}{{\text{i}}^{2+}}$ | $\text{M}{{\text{n}}^{2+}}$ |
| 开始沉淀的$\rm pH$ | $\rm 3.4$ | $\rm 1.5$ | $\rm 6.3$ | $\rm 6.2$ | $\rm 6.9$ | $\rm 8.1$ |
| 沉淀完全的$\rm pH$ | $\rm 4.7$ | $\rm 2.8$ | $\rm 8.3$ | $\rm 8.2$ | $\rm 8.9$ | $\rm 10.1$ |
回答下列问题:
基态锰原子的价层电子排布式为 。
$\\rm 3d^54s^2$
"]]锰为$\rm 25$号元素,基态锰原子的价层电子排布式为$\rm 3d^54s^2$;
硫化锰矿预先粉碎的目的是 。
增大接触面积,加快溶浸速率
"]]硫化锰矿预先粉碎的目的是:增大接触面积,加快溶浸速率;
“氧化”中$\text{Mn}{{\text{O}}_{2}}$将$\text{F}{{\text{e}}^{2+}}$氧化成$\text{F}{{\text{e}}^{3+}}$的离子方程式为 。
$\\text{Mn}{{\\text{O}}_{2}}+2\\text{F}{{\\text{e}}^{2+}}+4{{\\text{H}}^{+}}=\\text{M}{{\\text{n}}^{2+}}+2\\text{F}{{\\text{e}}^{3+}}+2{{\\text{H}}_{2}}\\text{O}$
"]]“氧化”中$\text{Mn}{{\text{O}}_{2}}$将$\text{F}{{\text{e}}^{2+}}$氧化成$\text{F}{{\text{e}}^{3+}}$,同时$\text{Mn}{{\text{O}}_{2}}$被还原生成$\text{M}{{\text{n}}^{\text{2}+}}$,反应的离子方程式为:$\text{Mn}{{\text{O}}_{2}}+2\text{F}{{\text{e}}^{2+}}+4{{\text{H}}^{+}}=\text{M}{{\text{n}}^{2+}}+2\text{F}{{\text{e}}^{3+}}+2{{\text{H}}_{2}}\text{O}$;
“调$\rm pH$”除铁、铝元素,溶液的$\rm pH$范围应调节为: $\leqslant \rm pH\lt 6.2$,滤渣$\rm 2$的主要成分是$\rm ($填化学式$\rm )$ 。
$\\rm 4.7$;$\\text{Fe}{{\\left( \\text{OH} \\right)}_{3}}$、$\\text{Al}{{\\left( \\text{OH} \\right)}_{3}}$
"]]“调$\rm pH$”除铁、铝元素,其$\rm pH$应不小于$\text{F}{{\text{e}}^{\text{3}+}} $、$\text{A}{{\text{l}}^{\text{3}+}}$完全沉淀所需的$\rm pH$且小于其它离子开始沉淀的$\rm pH$,在$\rm pH=4.7$时$\text{F}{{\text{e}}^{3+}}$和$\text{A}{{\text{l}}^{3+}}$沉淀完全,在$\rm pH=6.2$时$\text{Z}{{\text{n}}^{2+}}$开始沉淀,则溶液的$\rm pH$范围应调节为:$\rm 4.7\leqslant pH\lt 6.2$,由分析可知,滤渣$\rm 2$的主要成分是$\text{Fe}{{\left( \text{OH} \right)}_{3}}$、$\text{Al}{{\left( \text{OH} \right)}_{3}}$;
“除杂”的目的是除去$\text{Z}{{\text{n}}^{2+}}$和$\text{N}{{\text{i}}^{2+}}$,若“除杂”后滤液中$c\left( \text{N}{{\text{i}}^{2+}} \right)=1.0\times {{10}^{-5}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,则$c\left( \text{Z}{{\text{n}}^{2+}} \right)=$ $\mathrm{mol} \cdot \mathrm{L}^{-1}$。
$2.9\\times {{10}^{-9}}$
"]]若“除杂”后滤液中$c\left( \text{N}{{\text{i}}^{2+}} \right)=1.0\times {{10}^{-5}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,根据${{K}_{\text{sp}}}\left( \text{NiS} \right)=1.0\times {{10}^{-21}}$,则$c\left( {{\text{S}}^{2-}} \right)=\dfrac{{{K}_{\text{sp}}}\left( \text{NiS} \right)}{c\left( \text{N}{{\text{i}}^{2+}} \right)}=\dfrac{1.0\times {{10}^{-21}}}{1.0\times {{10}^{-5}}}\text{ mol}\cdot {{\text{L}}^{-1}}=1.0\times {{10}^{-16}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,${{K}_{\text{sp}}}\left( \text{ZnS} \right)=2.9\times {{10}^{-25}}$,则$c\left( \text{Z}{{\text{n}}^{2+}} \right)=\dfrac{{{K}_{\text{sp}}}\left( \text{ZnS} \right)}{c\left( {{\text{S}}^{2-}} \right)}=\dfrac{2.9\times {{10}^{-25}}}{1.0\times {{10}^{-16}}}\text{ mol}\cdot {{\text{L}}^{-1}}=2.9\times {{10}^{-9}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$;
“沉锰”中发生反应的离子方程式为 。
$\\rm \\text{M}{{\\text{n}}^{2+}}+2\\text{HCO}_{3}^{-}=\\text{MnC}{{\\text{O}}_{3}}\\downarrow +\\text{C}{{\\text{O}}_{2}}\\uparrow +{{\\text{H}}_{2}}\\text{O}$
"]]“沉锰”时$\rm \text{M}{{\text{n}}^{\text{2}+}} $和$\rm HCO_{3}^{-}$反应生成$\rm \text{MnC}{{\text{O}}_{\text{3}}}$、$\rm \text{C}{{\text{O}}_{2}}$和$\rm {{\text{H}}_{\text{2}}}\text{O}$,反应的离子方程式为:$\rm \text{M}{{\text{n}}^{2+}}+2\text{HCO}_{3}^{-}=\text{MnC}{{\text{O}}_{3}}\downarrow +\text{C}{{\text{O}}_{2}}\uparrow +{{\text{H}}_{2}}\text{O}$;
锰可与$\rm CO$形成金属羰基配合物$\text{M}{{\text{n}}_{2}}{{\left( \text{CO} \right)}_{10}}\rm ($熔点$\rm 154\;\rm ^\circ\rm C)$。其结构如图所示。则$\text{M}{{\text{n}}_{2}}{{\left( \text{CO} \right)}_{10}}$晶体中微粒间作用力有 $\rm ($填标号$\rm )$。
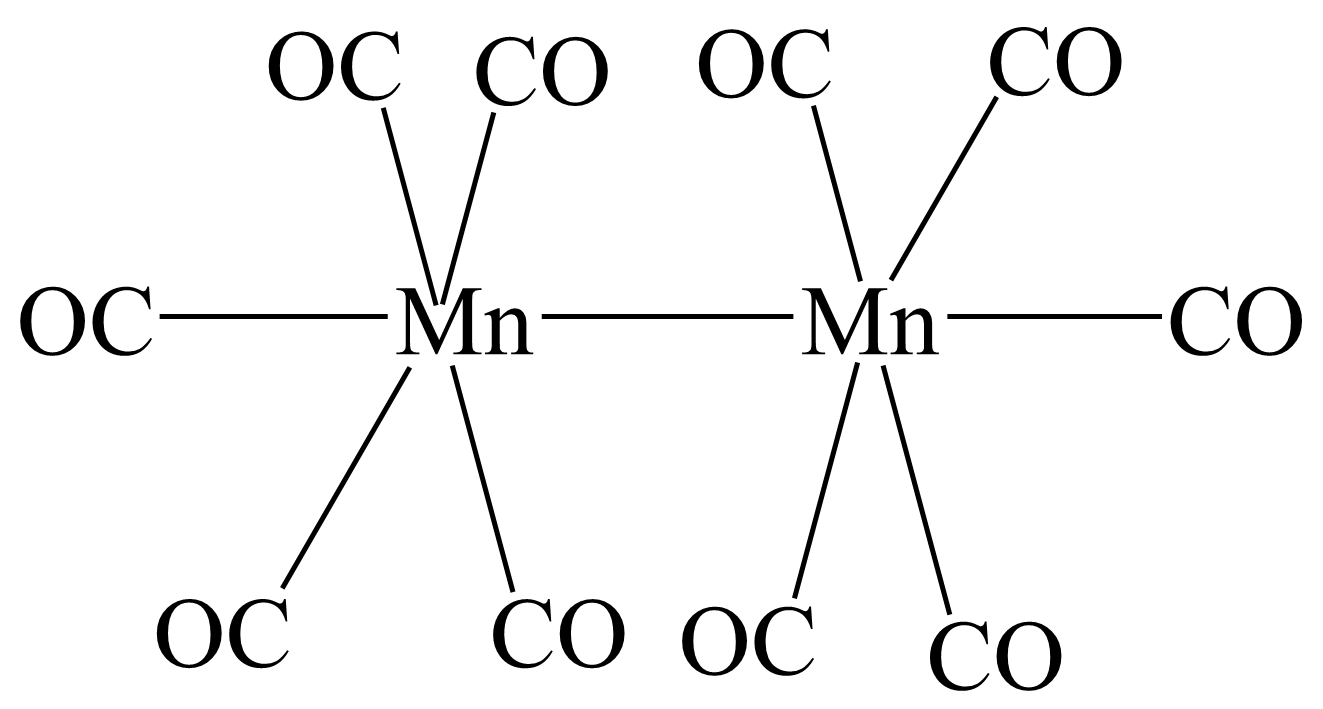
$\rm a$.配位键 $\rm b$.极性键 $\rm c$.范德华力 $\rm d$.离子键
$\\rm abc$
"]]由结构式可知,则$\text{M}{{\text{n}}_{2}}{{\left( \text{CO} \right)}_{10}}$晶体中微粒间作用力有$\rm CO$中碳和氧原子间的极性键、$\rm CO$与$\rm Mn$形成的配位键、$\rm Mn$与$\rm Mn$之间存在金属键,分子之间存在范德华力,但不存在离子键。
高中 | 配合物理论题目答案及解析(完整版)
