高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
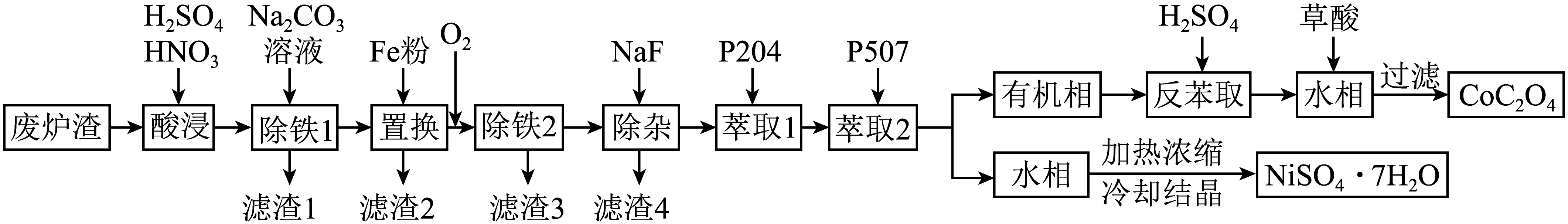
钴、镍是重要的战略物资,但资源匮乏。某冶金厂的废炉渣中含下列化学成分$\rm ($表$\rm 1)$。现用如下工艺流程从废炉渣中综合回收$\rm Cu$、$\rm Ni$、$\rm Co$。
表$\rm 1$废炉渣的主要化学成分
| 元素 | $\rm Cu$ | $\rm Co$ | $\rm Ni$ | $\rm Fe$ | $\rm Mn$ | $\rm Ca$ | $\rm Mg$ | $\rm Ti$ | $\rm Zn$ |
| 质量百分数$\rm /\%$ | $\rm 13.38$ | $\rm 1.53$ | $\rm 27.25$ | $\rm 16.8$ | $\rm \lt 0.01$ | $\rm 2.0$ | $\rm \lt 0.03$| | $\rm 0.03$ | $\rm \lt 0.01$ |
表$\rm 2$有机相中$\rm P204$体积分数对萃取除杂效果的影响
| $\rm \varphi(P204)/\%$ | 萃余液中金属离子质量浓度$\rm /(g\cdot L$⁻¹$\rm )$ | |||||
| $\rm Co^{2+}$ | $\rm Ni^{2+}$ | $\rm Cu^{2+}$ | $\rm Fe^{2+}$ | $\rm Zn^{2+}$ | $\rm Mn^{2+}$ | |
| $\rm 10$ | $\rm 1.45$ | $\rm 27.2$ | $\rm 0.017$ | $\rm \lt 0.005$ | $\rm 0.004$ | $\rm 0.01$ |
| $\rm 15$ | $\rm 1.40$ | $\rm 26.8$ | $\rm 0.005$ | $\rm \lt 0.005$ | $\rm 0.005$ | $\rm 0.005$ |
| $\rm 20$ | $\rm 1.20$ | $\rm 26.1$ | $\rm \lt 0.005$ | $\rm \lt 0.005$ | $\rm 0.005$ | $\rm 0.003$ |
已知:$\rm CaF_{2}$、$\rm MgF_{2}$难溶于水。
回答下列问题:
“酸浸”中稀硝酸需要缓慢加入反应液的原因是 。
控制反应速率,防止反应过于剧烈,避免液体飞溅或气体产生过快;
"]]稀硝酸是强氧化剂,可促进金属溶解,与反应液混合时反应剧烈,缓慢加入可控制反应速率,防止反应过于剧烈,避免液体飞溅或气体产生过快;
“除铁$\rm 1$”中发生除杂反应的离子方程式为 ;若省去此步骤,对后续步骤造成的影响是 。
$\\rm 3CO_{3}^{2-}+2F{{e}^{3+}}+3{{H}_{2}}O=2Fe{{(OH)}_{3}}\\downarrow +3C{{O}_{2}}\\uparrow $; 用铁粉置换铜步骤会消耗更多的铁粉 ;
"]]由分析可知,“除铁$\rm 1$”中发生除杂反应的离子方程式为:$\rm 3CO_{3}^{2-}+2F{{e}^{3+}}+3{{H}_{2}}O=2Fe{{(OH)}_{3}}\downarrow +3C{{O}_{2}}\uparrow $;若省去此步骤,用铁粉置换铜步骤会消耗更多的铁粉 ;
“滤渣$\rm 2$”中含有 。
铜和铁
"]]由分析可知,滤渣$\rm 2$中含有铜和铁;
“除铁$\rm 2$”的原理是溶液中的$\rm Fe_{2}(SO_{4})_{3}$和$\rm Na_{2}SO_{4}$在$\rm 90\ ^\circ\rm C$左右,产生黄钠铁矾晶体$\rm \left[ N{{a}_{2}}F{{e}_{6}}{{(S{{O}_{4}})}_{4}}{{(OH)}_{12}} \right]$请写出该反应的化学方程式: 。该步骤若加入$\rm N{{a}_{2}}C{{O}_{3}}$溶液,可以提高除铁效率,试从化学平衡角度解释原因: 。
$\\rm Fe_{2}(SO_{4})_{3}+Na_{2}SO_{4}+12H_{2}O\\begin{matrix} \\underline{\\underline{90\\ ^\\circ \\text{C}}} \\\\ {} \\\\\\end{matrix}Na_{2}Fe_{6}(SO_{4})_{4}(OH)_{12}↓+5H_{2}SO_{4}$ ;$\\rm {CO}_{3}^{2-}$与溶液中的$\\rm H^{+}$反应,降低$\\rm H^{+}$浓度,促使$\\rm Fe^{3+}$水解平衡$\\rm Fe^{3+}+$ $\\rm 3H_{2}O\\rightleftharpoons \\rm Fe(OH)_{3}$ $\\rm +$ $\\rm 3H^{+}$向右移动,更多$\\rm Fe^{3+}$转化为黄钠铁矾晶体,提高除铁效率;
"]]由分析可知,该反应的化学方程式:$\rm Fe_{2}(SO_{4})_{3}+Na_{2}SO_{4}+12H_{2}O\begin{matrix} \underline{\underline{90\ ^\circ \text{C}}} \\ {} \\\end{matrix}Na_{2}Fe_{6}(SO_{4})_{4}(OH)_{12}↓+5H_{2}SO_{4}$;该步骤若加入$\rm N{{a}_{2}}C{{O}_{3}}$溶液,$\rm \operatorname{CO}_{3}^{2-}$与溶液中的$\rm H^{+}$反应,降低$\rm H^{+}$浓度,促使$\rm Fe^{3+}$水解平衡$\rm Fe^{3+}+$ $\rm 3H_{2}O\rightleftharpoons \rm Fe(OH)_{3}$ $\rm +$ $\rm 3H^{+}$向右移动,更多$\rm Fe^{3+}$转化为黄钠铁矾晶体,提高除铁效率;
“萃取$\rm 1$”中有机相$\rm (P204-$煤油$\rm )$中$\rm P204$的体积分数不同,对金属离子的萃取效果也不同。表$\rm 2$是不同体积分数的$\rm P204-$煤油溶液萃取除杂的效果数据,最合适的是 $\rm \%$。
$\\rm 20$
"]]分析表中数据,萃取的目的是使萃余液中金属离子浓度尽可能低,当$\rm \varphi(P204)\%$为$\rm 20\%$时,萃余液中多种金属离子质量浓度最低,说明此时萃取效果最佳;
已知下图分别是萃取剂$\rm P204$和$\rm P507$的结构$\rm (R$是同一烃基$\rm )$,两物质中$\rm P=O$上的氧原子均可与$\rm Co^{2+}$配位形成配位化合物。请结合物质结构知识分析两者配位能力大小:$\rm O(P204)$ $\rm O(P507)($填“大于”“小于”或“等于”$\rm )$。
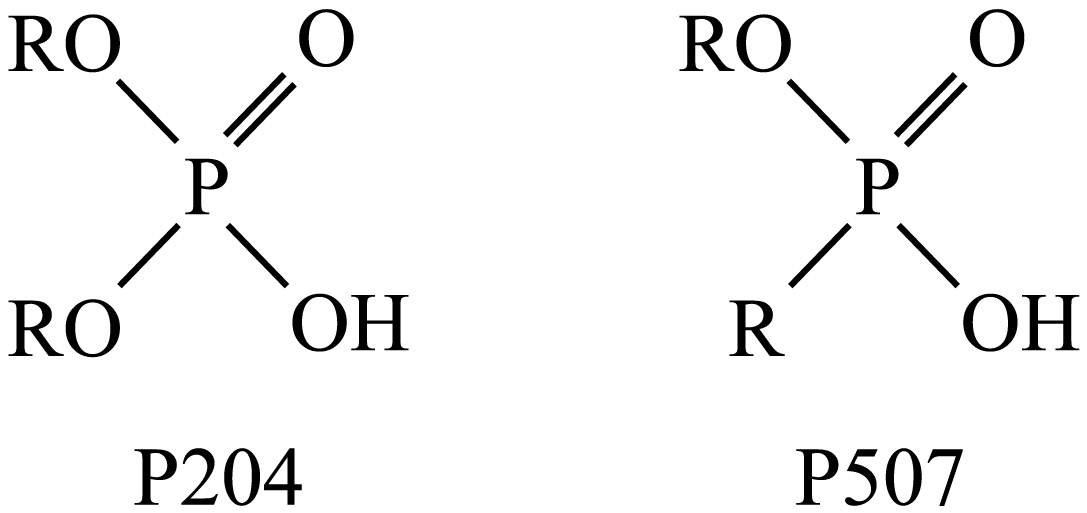
小于
"]]观察结构,$\rm P507$中与$\rm P$相连的基团为烃基$\rm (R)$,烃基给电子能力强,使$\rm P=O$上$\rm O$的电子云密度更大;而$\rm P204$中与$\rm P$相连的是$\rm RO$,$\rm P=O$上$\rm O$的电子云密度相对较小;电子云密度越大,配位能力越强,故$\rm O(P204)$ 小于 $\rm O(P507)$。
高中 | 配合物理论题目答案及解析(完整版)
