高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
氢能是一种极具发展潜力的清洁能源。下列反应是目前大规模制取氢气的方法。
$\text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)$
标准摩尔生成焓是指在标准大气压下,由最稳定的单质生成$\rm 1\;\rm mol$该物质的反应焓变。已知$\text{CO}\left( \text{g} \right)$、${{\text{H}}_{2}}\text{O}\left( \text{g} \right)$、$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$的标准摩尔生成焓分别是$-110.5\;\rm \text{kJ}/\text{mol}$、$-242\;\rm \text{kJ}/\text{mol}$、$-393.5 \mathrm{kJ} / \mathrm{mol}$,则上述反应的焓变$ \Delta H=$ 。
$-41\\;\\rm \\text{kJ}/\\text{mol}$
"]]根据标准摩尔生成焓的定义,反应的焓变等于生成物的生成焓之和减去反应物的生成焓之和,故$ \Delta { H}=\left( 242+110.5-393.5 \right)\text{ kJ}/\text{mol}=-41\;\rm \text{kJ}/\text{mol}$;
某化工厂在实验室模拟该反应过程,在容积不变的密闭容器中将$\rm 2.0\;\rm mol\;\rm CO$和$8.0\;\rm \text{mol}{{\text{ H}}_{2}}\text{O}$混合加热到$830\;^\circ \rm C $发生上述反应。
①下列条件能说明反应已经达到平衡状态的是 $\rm ($填字母$\rm )$。
$\rm A$.体系的总压强不再改变 $\rm B$.$\rm CO$和$\rm {{\text{H}}_{2}}\text{O}$的浓度之比不再变化
$\rm C$.${{v}_ {生成}}\left( \text{C}{{\text{O}}_{2}} \right)={{v}_ {消耗}}\left( \text{CO} \right)$ $\rm D$.$\text{C}{{\text{O}}_{2}}$和${{\text{H}}_{2}}$的浓度之比不再变化
②上述反应达到平衡时$\rm CO$的转化率为$80\%$,该温度下的平衡常数为 。若此时再向容器中充入$1\;\rm \text{mol}{{\text{ H}}_{2}}\text{O}$和$\text{C}{{\text{O}}_{2}}$,平衡将 $\rm ($填“正向移动”“逆向移动”或“不移动”$\rm )$,判断的理由是 。
③在生产中,欲提高反应的速率,同时提高$\rm CO$的转化率,下列措施可行的是 $\rm ($填字母$\rm )$。
$\rm A$.升高温度 $\rm B$.及时分离出$\rm {{\text{H}}_{2}}$ $\rm C$.增加水蒸气的投入量
$\rm D$.增大体系压强 $\rm E$.增大$\rm CO$的投入量
$\\rm B$;$\\rm 1$;逆向移动;$Q=\\dfrac{1.6\\times 2.6}{0.4\\times 7.4}\\gt K=1$,平衡逆移;$\\rm C$
"]]①$\rm A$.反应为气体物质的量不变的反应,压强为恒量,故压强不变不能作为判断的依据,$\rm A$项错误;
$\rm B$.$\rm CO$和$\rm {{\text{H}}_{2}}\text{O}$起始投入量之比为$\rm 1:4$,消耗量比为$\rm 1:1$,反应过程中物质的量比值会有变化,比值不变可以作为判断的依据,$\rm B$项正确;
$\rm C$.消耗$\rm CO$和生成$\rm \text{C}{{\text{O}}_{2}}$都是正反应,速率相同不能证明正、逆反应速率相等,$\rm C$项错误;
$\rm D$.无论平衡与否,生成$\rm \text{C}{{\text{O}}_{2}}$和$\rm {{\text{H}}_{2}}$的浓度始终相等,$\rm D$项错误;
故选:$\rm B$;
②$\rm CO$的转化率为$\rm 80\%$,即消耗$\rm CO\;1.6\;\rm mol$。据此列出三段式:
$\begin{matrix} {} & \text{CO}\left( \text{g} \right) & + & {{\text{H}}_{2}}\text{O}\left( \text{g} \right) & \rightleftharpoons & \text{C}{{\text{O}}_{2}}\left( \text{g} \right) & + & {{\text{H}}_{2}}\left( \text{g} \right) \\起始 /\text{mol} & 2 & {} & 8 & {} & 0 & {} & 0 \\转化 /\text{mol} & 1.6 & {} & 1.6 & {} & 1.6 & {} & 1.6 \\平衡 /\text{mol} & 0.4 & {} & 6.4 & {} & 1.6 & {} & 1.6 \\ \end{matrix}$
$ {K}=\dfrac{1.6\times 1.6}{0.4\times 6.4}=1$,再充入$\rm 1\;\rm mol{{\text{ H}}_{2}}\text{O}$和$\text{C}{{\text{O}}_{2}}$,计算$ {Q}=\dfrac{1.6\times 2.6}{0.4\times 7.4}\gt {K}=1$,故平衡逆向移动。
③$\rm A$.升高温度,平衡逆移,$\rm CO$转化率减小,$\rm A$项错误;
$\rm B$.及时分离出$\rm {{\text{H}}_{2}}$,平衡正移,但反应速率未增加,$\rm B$项错误;
$\rm C$.增加水蒸气的量,反应速率增大,平衡正移,$\rm CO$的转化率增大,$\rm C$项正确;
$\rm D$.增大压强,平衡不移动,$\rm CO$的转化率不变,$\rm D$项错误;
$\rm E$.增大$\rm CO$的投入量,$\rm CO$的转化率减小,$\rm E$项错误;
实验发现其他条件不变,在相同时间内,向上述体系中投入一定量的$\rm CaO$可以增大${{\text{H}}_{2}}$的体积分数,对比实验的结果如图$\rm 1$所示。
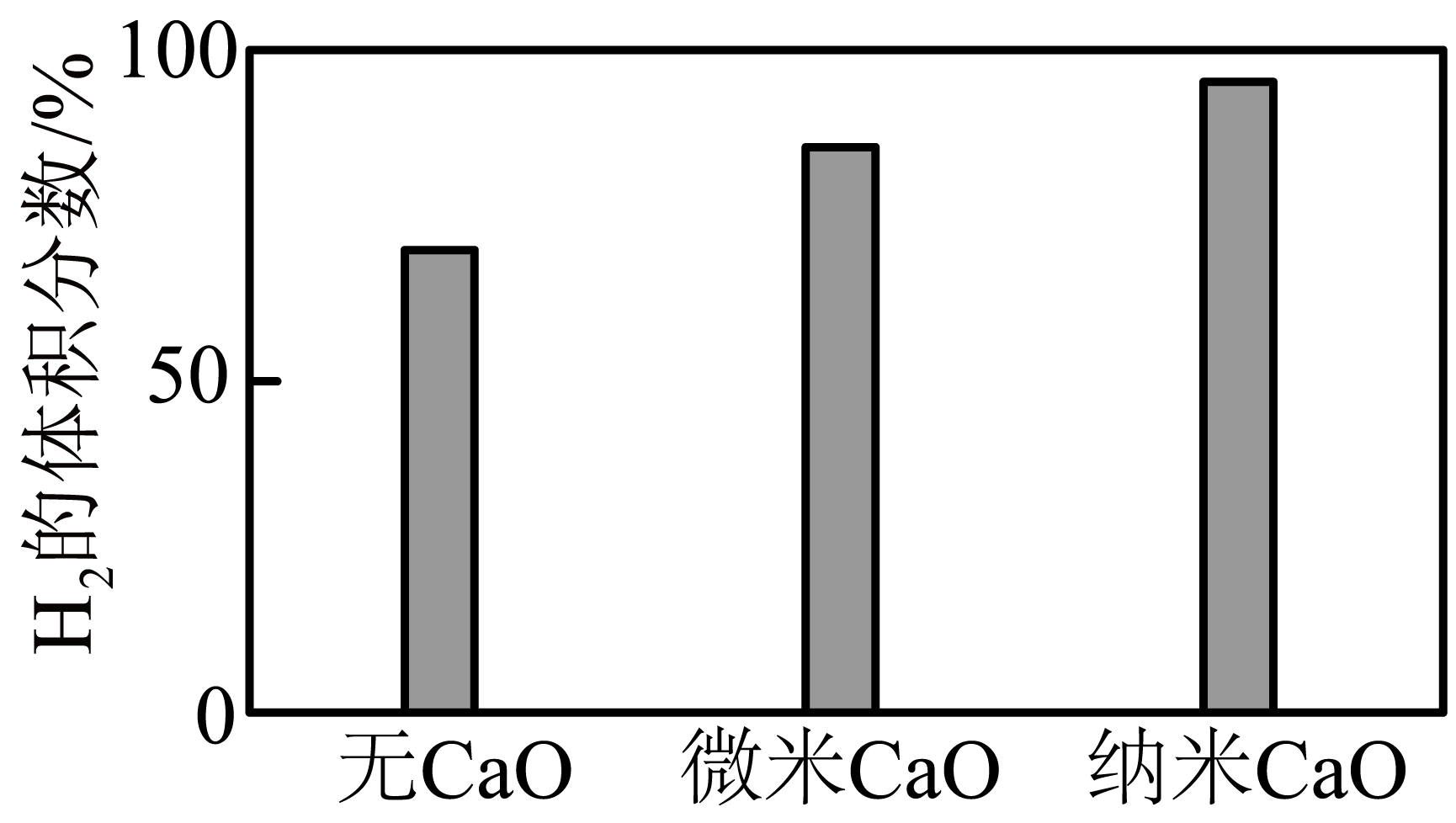
请解释图中${{\text{H}}_{2}}$体积分数变化的原因: 。
$\\rm CaO$吸收$\\text{C}{{\\text{O}}_{2}}$使$c\\left( \\text{C}{{\\text{O}}_{2}} \\right)$减小,平衡正移,${{\\text{H}}_{2}}$的体积分数增加,纳米$\\rm CaO$颗粒更小,表面积更大,使反应速率增大
"]]由图可知,$\rm CaO$可以增大$\rm H_{2}$的体积分数,且$\rm CaO$的颗粒越小,$\rm H_{2}$体积分数越大,因为$\rm CaO$吸收$\text{C}{{\text{O}}_{2}}$使$c\left( \text{C}{{\text{O}}_{2}} \right)$减小,平衡正移,${{\text{H}}_{2}}$的体积分数增加,纳米$\rm CaO$颗粒更小,表面积更大,使反应速率增大;
以氢氧燃料电池为电源,以丙烯腈$\left( \text{C}{{\text{H}}_{2}}=\text{CHCN} \right)$为原料电解制备己二腈$\left[ \text{NC}{{\left( \text{C}{{\text{H}}_{2}} \right)}_{4}}\text{CN} \right]$的装置简图如图$\rm 2$所示。图中交换膜$\rm 2$为阳离子交换膜,通入丙烯腈$\left( \text{C}{{\text{H}}_{2}}=\text{CHCN} \right)$电极的电极反应为 ,${{\text{H}}_{\text{2}}}$应从 $\rm ($填“电极$\rm a$”或“电极$\rm b$”$\rm )$通入。
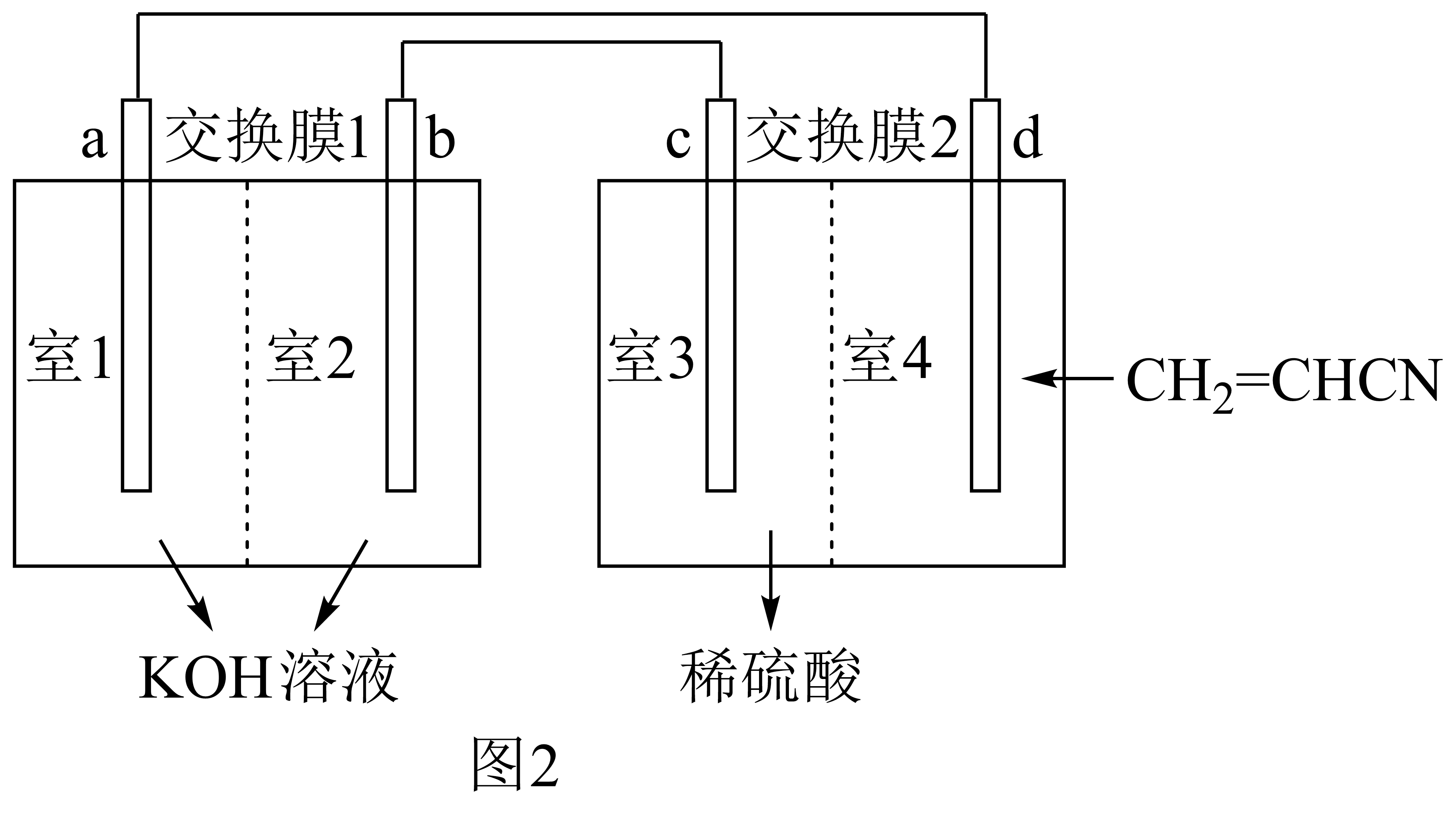
$\\rm 2\\text{C}{{\\text{H}}_{2}}=\\text{CHCN}+2{{\\text{e}}^{-}}+2{{\\text{H}}^{+}}=\\text{NC}{{\\left( \\text{C}{{\\text{H}}_{2}} \\right)}_{4}}\\text{CN}$;电极$\\rm a$
"]]由丙烯腈$\rm \left( \text{C}{{\text{H}}_{2}}=\text{CHCN} \right)$生成己二腈$\rm \left[ \text{NC}{{\left( \text{C}{{\text{H}}_{2}} \right)}_{4}}\text{CN} \right]$为还原反应,碳元素化合价降低得电子,电解液为稀硫酸,电极反应为$\rm 2\text{C}{{\text{H}}_{2}}=\text{CHCN}+2{{\text{e}}^{-}}+2{{\text{H}}^{+}}=\text{NC}{{\left( \text{C}{{\text{H}}_{2}} \right)}_{4}}\text{CN}$,反应得电子,在阴极上发生,氢氧燃料电池中通入$\rm {{\text{H}}_{2}}$的一极为负极,连接电解池的阴极,因此$\rm {{\text{H}}_{2}}$应通入电极$\rm a$。
高中 | 化学平衡常数题目答案及解析(完整版)
