高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
甲醚$\left( \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}} \right)$可用作气雾剂的抛射剂,也可作为制冷剂、局部麻醉药和燃料。
$\rm I$.工业上利用水煤气合成甲醚:
已知:
| 化学键 | $\rm C-H$ | $\rm C-O$ | $\rm H-H$ | $\text{C}=\text{O}\left( \text{C}{{\text{O}}_{\text{2}}} \right)$ | $\text{C}\equiv \text{O}$ |
| 键能$\rm /\left( \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}} \right)$ | $\rm 413$ | $\rm 351$ | $\rm 436$ | $\rm 803$ | $\rm 1071$ |
水煤气合成甲醚发生反应的热化学方程式:$3\text{CO}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\quad \Delta H=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,该反应在 $\rm ($填“高温”“低温”或“任意条件”$\rm )$下可自发进行。
$-265$ ; 低温
"]]根据$\Delta H=$反应物总键能$\rm -$生成物总键能,水煤气合成甲醚发生反应$3\text{CO}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})\quad \Delta H=(1071\times 3+436\times 3)-(413\times 6+351\times 2+803\times 2)\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}=-265\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,根据反应自发进行的判据:$\Delta G=\Delta H-T\Delta S\lt 0$,$3\text{CO}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})$的$\Delta H\lt 0$、$\Delta S\lt 0$,所以反应$3\text{CO}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})$需要低温下发生;
一定温度下,在$\rm 2$ $\rm L$恒容密闭容器中投入$\text{3 mol }{{\text{H}}_{\text{2}}}(\text{g})$和$\text{3 mol CO(g})$发生上述反应,当容器内压强不再发生变化时,下列说法正确的是 $\rm ($填标号$\rm )$。
$\rm A$.该反应达到最大限度
$\rm B$.$\rm \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$的百分含量不再发生变化
$\rm C$.$\rm {{\text{H}}_{2}}$、$\rm CO$全部转化为$\rm \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$和$\rm \text{C}{{\text{O}}_{2}}$
$\rm D$.$\rm CO$、$\text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$、$\text{C}{{\text{O}}_{2}}$的浓度一定相等
$\\rm AB$
"]]一定温度下,在$\rm 2$ $\rm L$恒容密闭容器中投入$\text{3 mol }{{\text{H}}_{\text{2}}}(\text{g})$和$\text{3 mol CO(g})$发生反应$3\text{CO}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}(\text{g})+\text{C}{{\text{O}}_{2}}(\text{g})$,当容器内压强不再发生变化时,说明该反应达到了平衡状态。
$\rm A$. 该反应达到了平衡状态,即为该反应达到最大限度,$\rm A$正确;
$\rm B$. 该反应达到了平衡状态,$\rm \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$的百分含量不再发生变化,$\rm B$正确;
$\rm C$. 反应为可逆反应,$\rm {{\text{H}}_{2}}$、$\rm CO$不会全部转化为$\rm \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$和$\rm \text{C}{{\text{O}}_{2}}$,$\rm C$错误;
$\rm D$. 该反应达到平衡状态时,$\rm CO$、$\rm \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$、$\rm \text{C}{{\text{O}}_{2}}$的浓度不一定相等,$\rm D$错误;
故选:$\rm AB$;
Ⅱ.利用$\text{C}{{\text{O}}_{2}}$催化加氢合成甲醚,主要发生的反应如下:
反应①:$2\text{C}{{\text{O}}_{2}}(\text{g})+6{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}(\text{g})+3{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta {{H}_{1}}$ ;
反应②:$\text{C}{{\text{O}}_{2}}(\text{g})+{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{CO(g})+{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta {{H}_{2}}=+41.2\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$ 。
恒定压强为${{p}_{0}}\text{ MPa}$时,若开始投入的$\text{C}{{\text{O}}_{2}}$、${{\text{H}}_{2}}$分别为$a\text{ mol}$、$2a\text{ mol}$,$\text{C}{{\text{O}}_{2}}$平衡转化率和平衡时$\text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$的选择性随温度的变化如图。已知:$\text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$的选择性$=\dfrac{\text{2}{{n}_{生成}}\left( \text{C}{{\text{H}}_{\text{3}}}\text{OC}{{\text{H}}_{\text{3}}} \right)}{{{n}_{消耗}}\left( \text{C}{{\text{O}}_{\text{2}}} \right)}\times 100\%$。
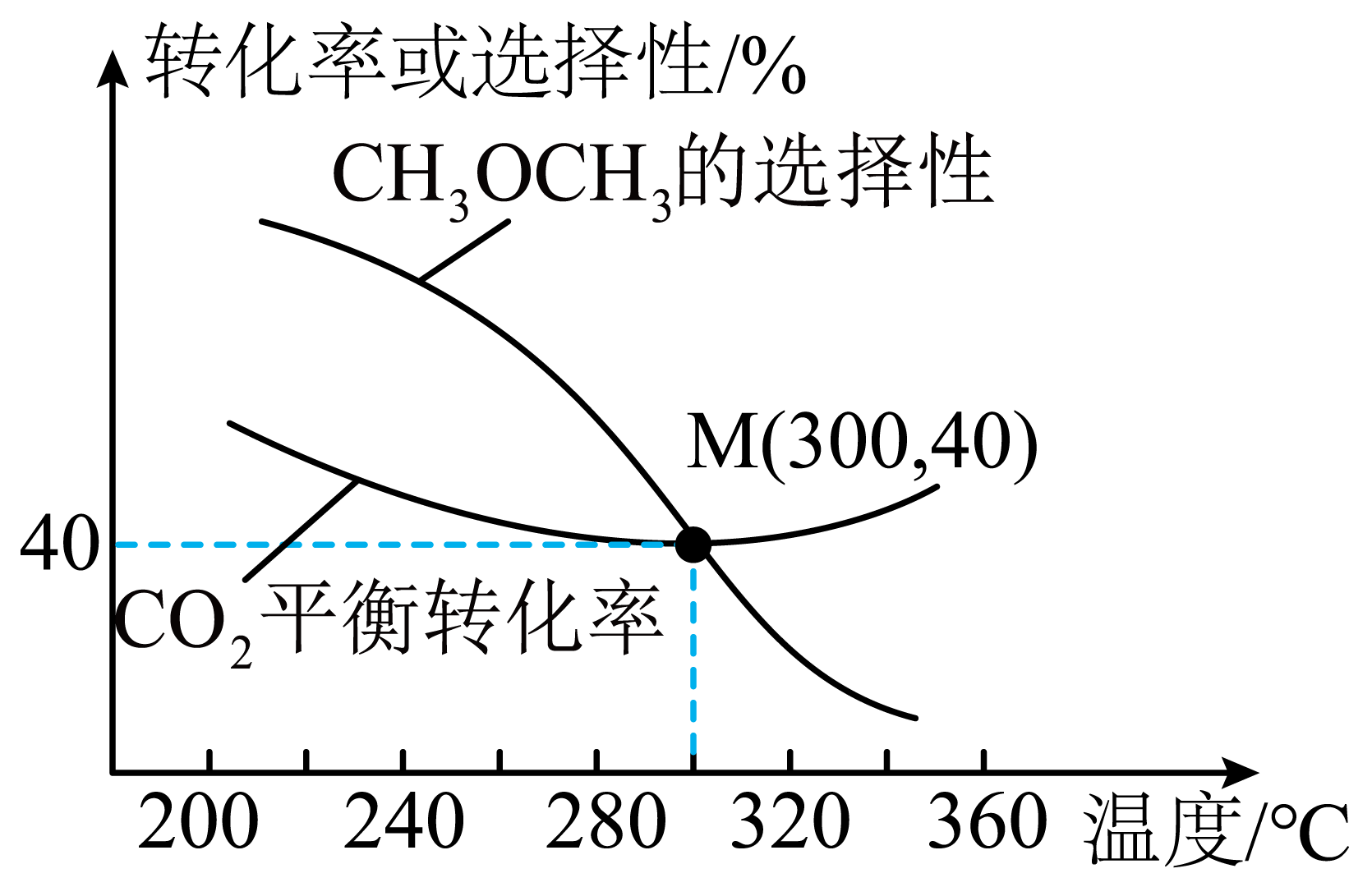
$\rm 240\ ^\circ\rm C$时,若不改变反应温度,能提高$\text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$平衡产率的措施有 $\rm ($任写一条$\rm )$。
压缩容器体积
"]]反应①是气体分子数减小的反应,反应②是气体分子数不变的反应,通过加压使反应①平衡正向移动,或者加入有利于反应①进行的催化剂,可以提高$\text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$选择性;
由图可知,升高温度,$\text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$的选择性减小,推断出$\Delta {{H}_{\text{1}}}$ $\rm ($填“$\rm \gt $”或“$\rm \lt $”$\rm )0$。
$\\rm \\lt $
"]]由图可知,升高温度,$\text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}$的选择性减小,则反应①:$2\text{C}{{\text{O}}_{2}}(\text{g})+6{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}(\text{g})+3{{\text{H}}_{2}}\text{O}(\text{g})$平衡逆向移动,可推断出$\Delta {{H}_{\text{1}}}\rm \lt $ $\rm 0$;
$\rm 300$ $\rm ^\circ\rm C$时,若$\rm 10$ $\rm min$时反应达到平衡状态,此时$n\left( \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}} \right)=$ $\rm \;\rm mol$,反应②的压强平衡常数${{K}_{\text{p}}}=$ 。
$0.08a$ ; $\\dfrac{3}{20}$或$\\rm 0.15$
"]]$\rm 300$ $\rm ^\circ\rm C$时,若$\rm 10$ $\rm min$时反应达到平衡状态,$\rm CO_{2}$的平衡转化率为$\rm 40\%$,则消耗$\text{C}{{\text{O}}_{\text{2}}}\text{ }0.4a\text{ mol}$,$\rm CH_{3}OCH_{3}$的选择性为$\rm 40\%$,则生成$\rm CH_{3}OCH_{3}$的物质的量为$\dfrac{0.4\times 0.4a\text{ mol}}{2}=0.08a\text{ mol}$;即平衡时生成$\rm CH_{3}OCH_{3}$的物质的量为$0.08a\text{ mol}$;根据生成$\rm CH_{3}OCH_{3}$的物质的量为$0.08a\text{ mol}$,消耗$\text{C}{{\text{O}}_{\text{2}}}\text{ }0.4a\text{ mol}$,列出三段式计算:
$\begin{matrix} {} & 2\text{C}{{\text{O}}_{2}}\left( \text{g} \right) & + & 6{{\text{H}}_{2}}\left( \text{g} \right) & \rightleftharpoons & \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}\left( \text{g} \right) & + & 3{{\text{H}}_{2}}\text{O}\left( \text{g} \right) \\起 \left( \text{mol} \right) & a & {} & 2a & {} & 0 & {} & 0 \\ 变\left( \text{mol} \right) & 0.16a & {} & 0.48a & {} & 0.08a & {} & 0.24a \\平 \left( \text{mol} \right) & 0.84a & {} & 1.52a & {} & 0.08a & {} & 0.24a \\ \end{matrix}$
$\begin{matrix} {} & \text{C}{{\text{O}}_{2}}\left( \text{g} \right) & + & {{\text{H}}_{2}}\left( \text{g} \right) & \rightleftharpoons & \text{CO}\left( \text{g} \right) & + & {{\text{H}}_{2}}\text{O}\left( \text{g} \right) \\起 \left( \text{mol} \right) & 0.84a & {} & 1.52a & {} & 0 & {} & 0.24a \\变 \left( \text{mol} \right) & 0.24a & {} & 0.24a & {} & 0.24a & {} & 0.24a \\平 \left( \text{mol} \right) & 0.6a & {} & 1.28a & {} & 0.24a & {} & 0.48a \\ \end{matrix}$
则平衡时二氧化碳、氢气、甲醚、一氧化碳、水蒸气的物质的量分别为$0.6a$ $\rm mol$、$1.28a\text{ }$ $\rm mol$、$\rm 0.08$ $\rm mol$、$0.24a\text{ }$ $\rm mol$、$0.48a$ $\rm mol$,则混合气体的总物质的量为$2.68a\text{ }\rm mol$,反应②的平衡常数${{K}_{\text{p}}}=\dfrac{\left( {{p}_{0}}\text{ MPa}\times \dfrac{0.48a\text{ mol}}{\text{2}\text{.68}a\text{ mol}} \right)\times \left( {{p}_{0}}\text{ MPa}\times \dfrac{0.24a\text{ mol}}{\text{2}\text{.68}a\text{ mol}} \right)}{\left( {{p}_{0}}\text{ MPa}\times \dfrac{1.28a\text{ mol}}{\text{2}\text{.68}a\text{ mol}} \right)\times \left( {{p}_{0}}\text{ MPa}\times \dfrac{\text{0}\text{.6}a\text{ mol}}{\text{2}\text{.68}a\text{ mol}} \right)}\rm =0.15$;
比较不同温度下反应①的平衡常数:$K\rm (200$ $\rm ^\circ\rm C)$ $\rm ($填“$\rm \gt $”或“$\rm \lt $”$ )K\rm (300$ $\rm ^\circ\rm C)$。
$\\rm \\gt $
"]]反应①:$2\text{C}{{\text{O}}_{2}}(\text{g})+6{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OC}{{\text{H}}_{3}}(\text{g})+3{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta {{H}_{\text{1}}}\lt 0$ ,升高温度,平衡逆向移动,平衡常数减小,则不同温度下反应①的平衡常数:$K\left( 200\ {}^\circ \text{C} \right)\gt K\left( 300\ {}^\circ \text{C} \right)$。
高中 | 化学平衡常数题目答案及解析(完整版)
