高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
甲醇是主要的有机原料,常利用$\rm CH_{4}$、$\rm CO_{2}$等进行制备。回答下列问题:
Ⅰ.甲烷选择性氧化制备甲醇是一种原子利用率高的方法。
${\rm 2CH_{4}(g)+O_{2}(g)=2CH_{3}OH(l)}\quad\Delta H=-329\rm \ kJ/mol$,该反应的正反应方向在 $\rm ($填“高温”或“低温”$\rm )$条件下更有利于其自发进行。
低温
"]]${\rm 2CH_{4}(g)+O_{2}(g)=2CH_{3}OH(l)}\quad\Delta H=-329\rm \ kJ/mol$,该反应的正反应方向:$\Delta S\lt 0$,$\Delta H\lt 0$,则在低温条件下更有利于其自发进行。
已知大多数气体分子在催化剂表面的吸附过程是放热的。从反应速率的角度分析,通入$\rm CH_{4}$后将体系温度维持在$\rm 200\ ^\circ\rm C$的原因是 $\rm ($不考虑催化剂活性变化$\rm )$。
温度过低,反应速率降低;温度过高,反应物在催化剂表面的吸附量减少成为主因,也会导致反应速率减小
"]]已知大多数气体分子在催化剂表面的吸附过程是放热的,所以温度过低,虽然有利于气体在催化剂表面的吸附,但对提高反应速率不利;温度过高,不利于气体在催化剂表面的吸附,但对提高反应速率有利。从反应速率的角度分析,通入$\rm CH_{4}$后将体系温度维持在$\rm 200\ ^\circ\rm C$的原因是:温度过低,反应速率降低;温度过高,反应物在催化剂表面的吸附量减少成为主因,也会导致反应速率减小;
Ⅱ.利用合成气$\rm CO$、$\rm H$₂制备甲醇,涉及的反应如下:
反应①:${\rm CO_{2}(g)+3H_{2}(g)=CH_{3}OH(g)+H_{2}O(g)}\quad\Delta H_{1}\lt 0$
反应②:${\rm CO_{2}(g)+H_{2}(g)=CO(g)+H_{2}O(g)}\quad\Delta H_{2}\gt 0$
在不同压强下,按照$n{\rm (CO_{2})}:n{\rm (H_{2})}=1:3$进行投料,在容器中发生反应①、②,平衡时,$\rm CO$和 $\rm CH_{3}OH$在含碳产物$\rm ($即 $\rm CH_{3}OH$和$\rm CO)$中物质的量分数及 $\rm CO_{2}$的转化率随温度的变化如下图所示。
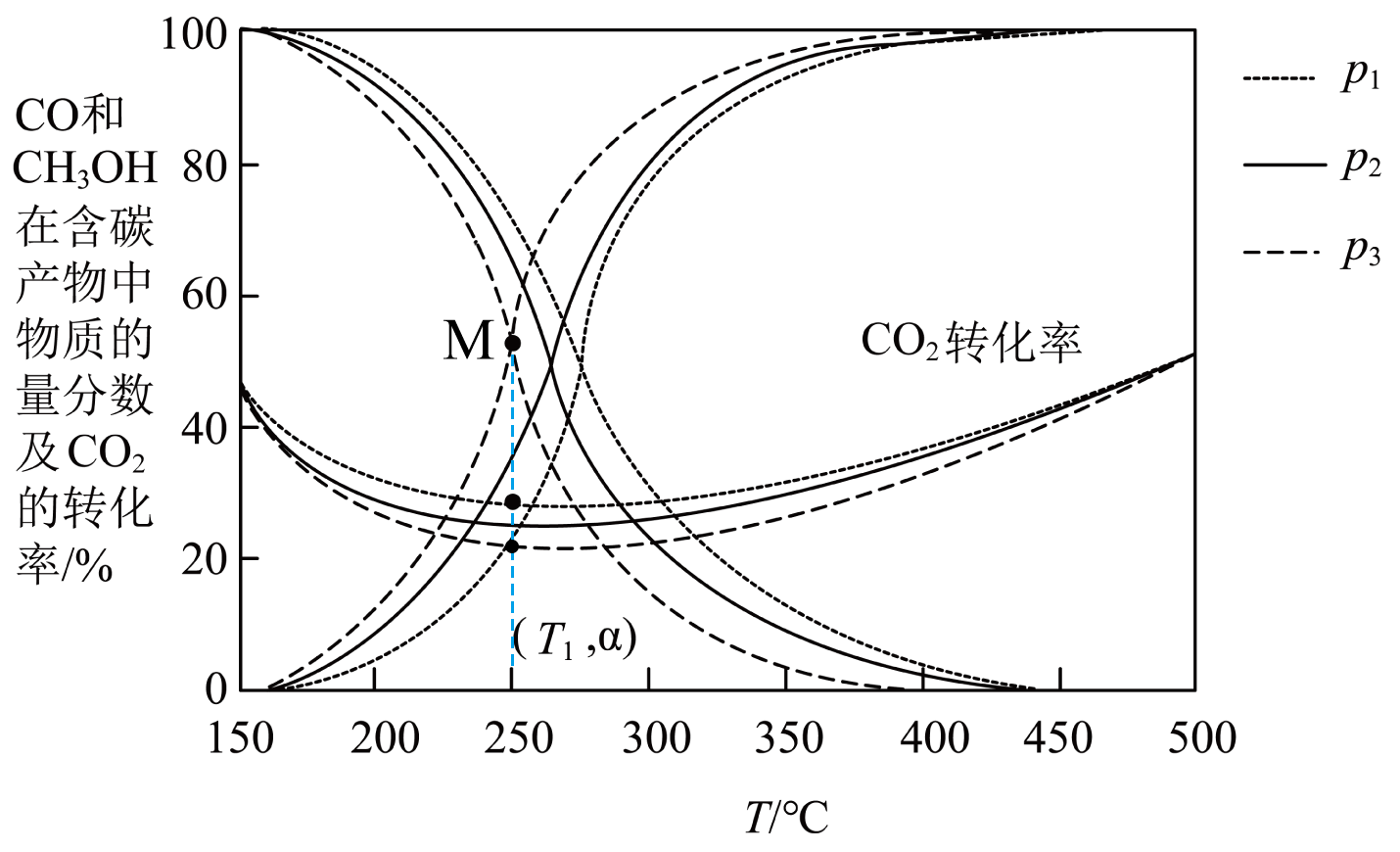
判断图中压强。 $p_{1}$、$p_{2}$、$p_{3}$大到小的顺序为 。
$p_{1}\\gt p_{2}\\gt p_{3}$
"]]反应①:${\rm CO_{2}(g)+3H_{2}(g)=CH_{3}OH(g) +H_{2}O(g)}\quad\Delta H_{1}\lt 0$
反应②:${\rm CO_{2}(g)+H_{2}(g)=CO(g)+H_{2}O(g)}\quad\Delta H_{2}\gt 0$
由于反应①的$\Delta H_{1}\lt 0$、反应②的$\Delta H_{2}\gt 0$,低温时有利于反应①,所以下降的曲线为$\rm CH_{3}OH(g)$的物质的量分数随温度变化的曲线,上升的曲线为$\rm CO(g)$的物质的量分数随温度变化的曲线。
对于反应①,温度一定时,增大压强,平衡正向移动,$\rm CH_{3}OH(g)$的物质的量分数增大,则
图中压强$p_{1}$、$p_{2}$、$p_{3}$由大到小的顺序为$p_{1}\gt p_{2}\gt p_{3}$。
压强不变时,分析升温过程中$\rm CO_{2}$转化率变化的原因: 。
升高温度,反应①平衡逆向移动,反应②平衡正向移动。$\\rm 250\\ ^\\circ\\rm C$前,温度升高对反应①的影响是主要的,使$\\rm CO_{2}$的转化率降低,$\\rm 250\\ ^\\circ\\rm C$后,温度升高对反应②的影响是主要的,使$\\rm CO_{2}$的转化率升高
"]]压强不变时,升高温度,反应①平衡逆向移动,反应②平衡正向移动,则升温过程中,$\rm CO_{2}$转化率变化的原因:升高温度,反应①平衡逆向移动,反应②平衡正向移动。$\rm 250\ ^\circ\rm C$前,温度升高对反应①的影响是主要的,使$\rm CO_{2}$的转化率降低,$\rm 250\ ^\circ\rm C$后,温度升高对反应②的影响是主要的,使$\rm CO_{2}$的转化率升高。
在某恒温恒容体系中,按起始$c{\rm (CO_{2})}=1\rm \ mol/L$、$c{\rm (H_{2})}=3\rm \ mol/L$进行实验,平衡时 $\rm CH_{3}OH$的物质的量分数为点$M$,此时$\rm (CO_{2}$转化率为$\rm 20\%$,则该条件下反应②正反应的平衡常数$K=$ (保留一位有效数字$\rm )$。
$\\rm 0.01$
"]]在某恒温恒容体系中,按起始$c{\rm (CO_{2})}=1\rm \ mol/L$、$c{\rm (H_{2})}=3\rm \ mol/L$进行实验,平衡时$\rm CH_{3}OH$和$\rm CO$的物质的量分数为点$M$,此时二者的物质的量分数都为$\rm 50\%$,$\rm CO_{2}$转化率为$\rm 20\%$,则参加反应$\rm CO_{2}$的物质的量为$\rm 1\ mol\times 20\%=0.2\ mol$。设反应①中参加反应$\rm CO_{2}$的物质的量为$x$,则反应②中参加反应$\rm CO_{2}$的物质的量为$(0.2-x)\ \rm mol$,由此可建立如下三段式:
$\rm \begin{matrix} {} & \rm C{{O}_{2}}(g) & + & \rm 3{{H}_{2}}(g) & \rightleftharpoons & \rm C{{H}_{3}}OH(g) & + & \rm {{H}_{2}}O(g) \\ 起始量\rm (mol/L) & 1 & {} & 3 & {} & 0 & {} & 0 \\ 变化量\rm (mol/L) & x & {} & 3x & {} & x & {} & x \\ 平衡量\rm (mol/L) & 0.8 & {} & 2.8-2x & {} & x & {} & 0.2 \\ \end{matrix}$
$\rm \begin{matrix} {} & \rm C{{O}_{2}}(g) & + & \rm {{H}_{2}}(g) & \rightleftharpoons & \rm CO(g) & + & \rm {{H}_{2}}O(g) \\ 起始量\rm (mol/L) & 1 & {} & 3 & {} & 0 & {} & 0 \\ 变化量(mol/L) & 0.2-x & {} & 0.2-x & {} & 0.2-x & {} & 0.2-x \\ 平衡量\rm (mol/L) & 0.8 & {} & 2.8-2x & {} & 0.2-x & {} & 0.2 \\ \end{matrix}$
$x=0.2-x$,$x=0.1\rm \ mol$,则该条件下反应②正反应的平衡常数$K=\dfrac{c{\rm (CO)}\cdot c{\rm ({{H}_{2}}O)}}{c{\rm (C{{O}_{2}})}\cdot c{\rm ({{H}_{2}})}}\rm =\dfrac{0.1\ mol/L\times 0.2\ mol/L}{0.8\ mol/L\times 2.6\ mol/L}\rm ≈0.01$。
Ⅲ.科学家设计如图所示装置$\rm ($串联光电催化反应池$\rm )$减少$\rm CO_{2}$排放并获取制备甲醇的原料$\rm CH_{4}$。
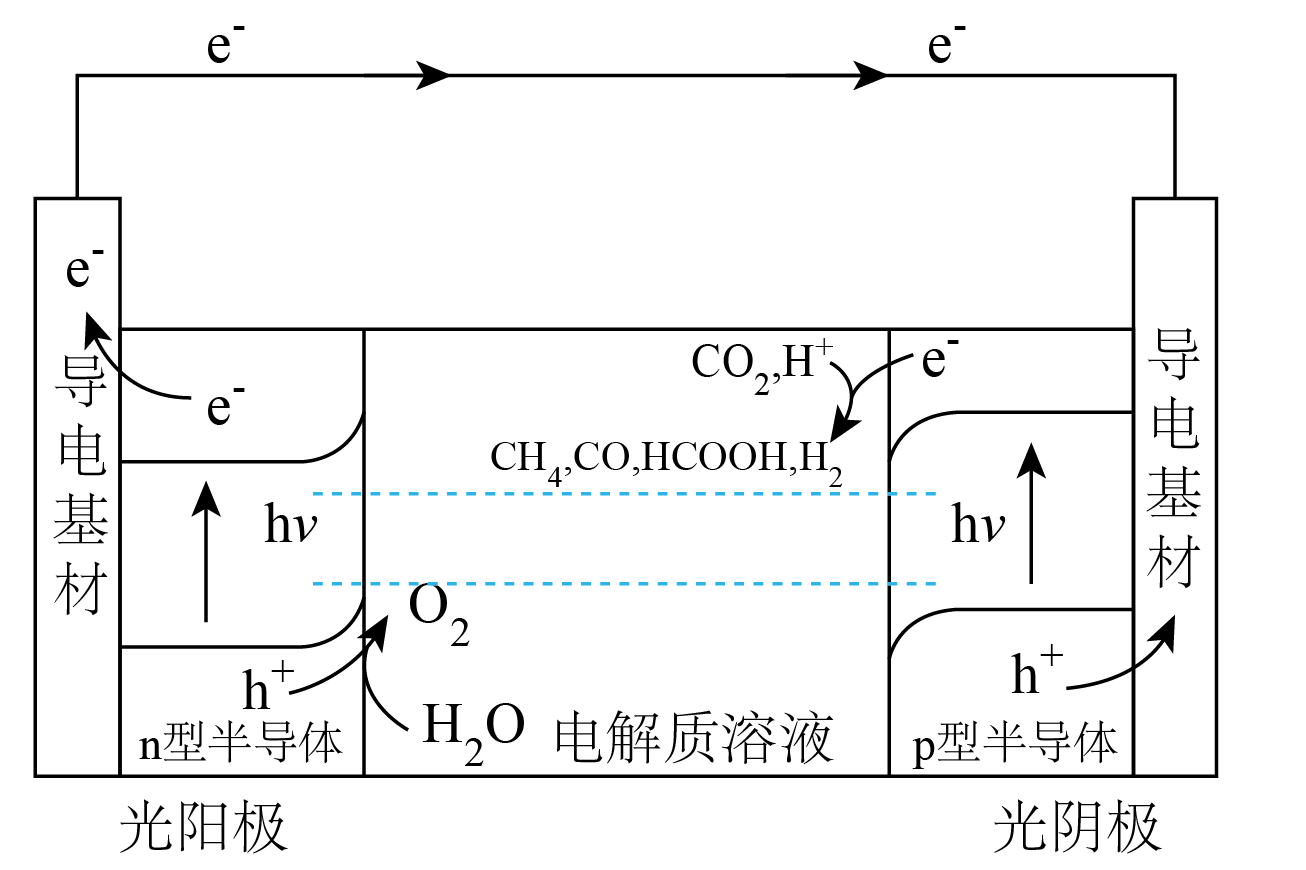
光催化电池中的半导体是在晶体硅中掺杂硼原子和磷原子实现的。$\rm p$型半导体也称为空穴型半导体,$\rm n$型半导体也称为电子型半导体。据此,推测 $\rm n$型半导体掺杂的是 $\rm ($填元素符号$\rm )$。
$\\rm P$
"]]$\rm B$比$\rm Si$少$\rm 1$个价电子,二者结合后形成空穴,导致空穴导电;$\rm P$比$\rm Si$多$\rm 1$个价电子,二者结合后,多出$\rm 1$个自由电子,能提供电子导电。$\rm p$型半导体也称为空穴型半导体,$\rm n$型半导体也称为电子型半导体。据此,推测 $\rm n$型半导体掺杂的是$\rm P$。
产生 $\rm CH_{4}$的电极反应式为 。
$\\rm CO_{2}+8e^{-}+8H^{+}=CH_{4}+2H_{2}O$
"]]从图中可以看出,在光阳极,$\rm H_{2}O$失电子生成$\rm O_{2}$等;在光阴极,$\rm CO_{2}$、$\rm H^{+}$得电子生成$\rm CH_{4}$等,则依据得失电子守恒、电荷守恒和元素守恒,可得出产生$\rm CH_{4}$的电极反应式为$\rm CO_{2}+8e^{-}+8H^{+}=CH_{4}+2H_{2}O$。
高中 | 化学平衡常数题目答案及解析(完整版)
