高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
降低空气中$\text{C}{{\text{O}}_{2}}$的含量,研发$\text{C}{{\text{O}}_{2}}$的利用技术,将$\text{C}{{\text{O}}_{2}}$转换为能源是缓解环境和能源问题的有效方案之一,我国为实现碳达峰和碳中和的“双碳”目标,工业上用${{\text{H}}_{2}}$、${{\text{H}}_{2}}\text{O}$、${{\text{C}}_{3}}{{\text{H}}_{8}}$等物质与$\text{C}{{\text{O}}_{2}}$反应合成具有经济价值的物质。
工业上用$\text{C}{{\text{O}}_{2}}$和${{\text{H}}_{2}}$合成$\text{C}{{\text{H}}_{3}}\text{OH}$,发生的主反应ⅰ:$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\qquad\Delta {{ {H}}_{\text{1}}}$。
| ${{\text{H}}_{2}}$ | $\text{C}{{\text{H}}_{3}}\text{OH}$ | $\text{C}{{\text{O}}_{2}}$ | ${{\text{H}}_{2}}\text{O}$ | |
| 相对能量$\left( \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}} \right)$ | $\rm 0$ | $\rm -201.0$ | $\rm -393.0$ | $\rm -242.0$ |
根据表中数据计算$\Delta {{H}_{1}}=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
$\\rm -50.0$
"]]根据反应热$\Delta H\rm =$生成物的总能量 $\rm -$ 反应物的总能量。
对于反应$\text{C}{{\text{O}}_{\text{2}}}\text{(g)+3}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)+}{{\text{H}}_{\text{2}}}\text{O(g)}$,$\Delta{{ {H}}_{\text{1}}}\text{=(-201}\text{.0-242}\text{.0)-(-393}\text{.0+0}\times {3)=-50\;\rm kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$。
一定条件下,向$\rm 2\;\rm L$恒温恒容密闭容器中充入$1\text{ mol C}{{\text{O}}_{2}}\left( \text{g} \right)$和$3\;\rm \text{mol }{{\text{H}}_{2}}\left( \text{g} \right)$仅发生反应ⅰ,在两种不同催化剂作用下建立平衡的过程$\rm ($Ⅰ,Ⅱ$\rm )$中$\text{C}{{\text{O}}_{2}}$的转化率随反应时间的变化曲线如图。
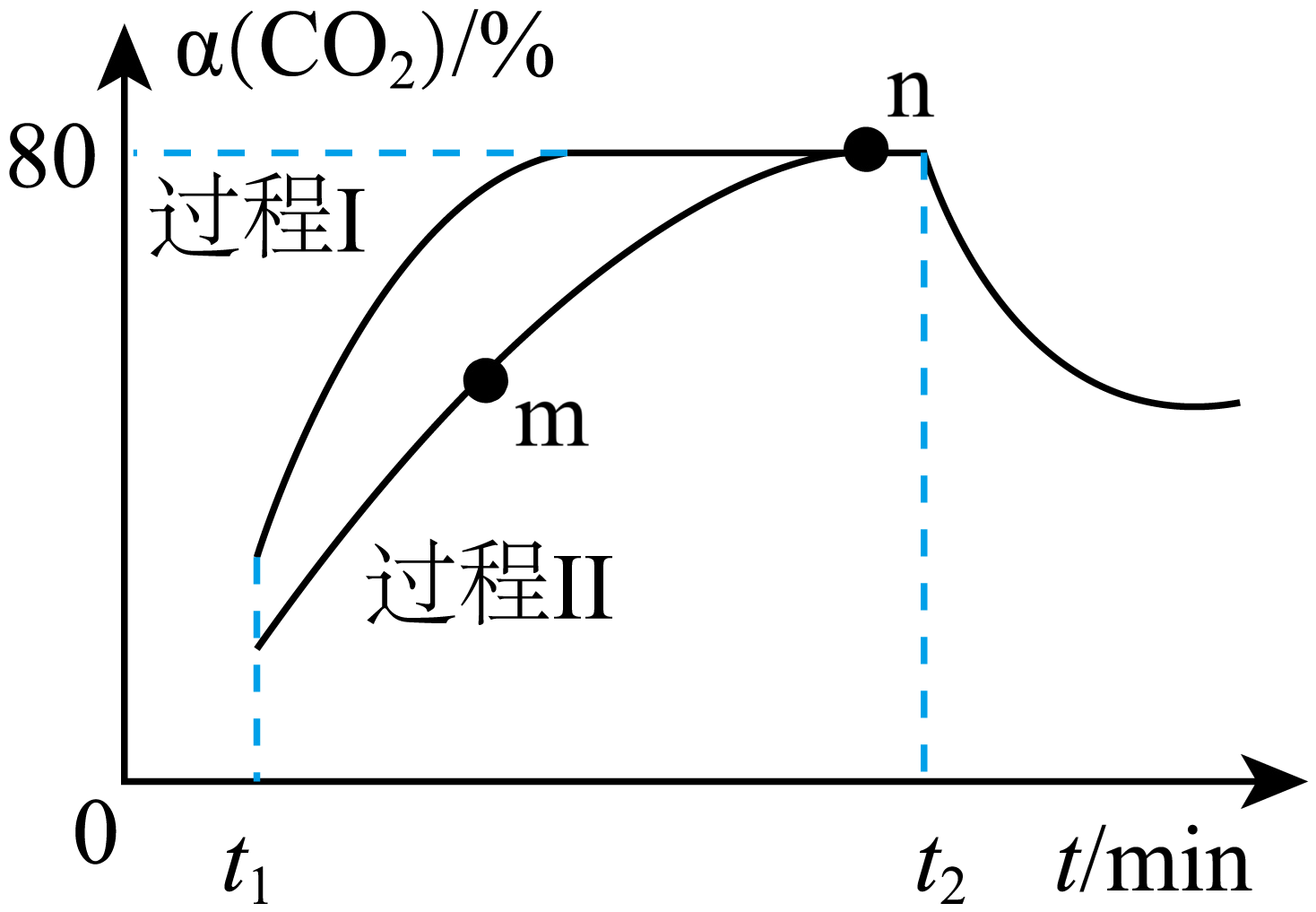
①$\rm n$点${{v}_逆{}}$ $\rm m$点${{v}_正{}}\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$。
②计算反应处于$\rm n$点的平衡常数$K=$ $\rm ($保留两位小数$\rm )$。
③过程Ⅰ,${{t}_{2}}$时刻改变的反应条件可能是 $\rm ($任答一条$\rm )$。
$\\rm \\lt $;$\\rm 59.26$;升高温度$\\rm ($或增大生成物浓度$\\rm )$
"]]①$\rm n$点处于平衡状态,正逆反应速率相等,$\rm m$点没有达到平衡状态,其正反应速率大于$\rm n$点正反应速率,故$\rm n$点${{ {v}}_逆{}}\rm \lt m$ 点${{ {v}}_正{}}$。
②向${2\;\rm L}$恒温恒容密闭容器中充入${1\;\rm mol\;\rm C}\rm {{{O}}_{{2}}}$和${3\;\rm mol}\rm \;{{{H}}_{{2}}}$,$\rm n$点时$\rm {C}{{{O}}_{{2}}}$的转化率为$\rm 80\%$,则:
$\begin{matrix} {} &\rm {C}{{{O}}_{{2}}}{(g)} &\rm +{3}{{{H}}_{{2}}}{(g)} & \rightleftharpoons &\rm {C}{{{H}}_{{3}}}{OH(g)} &\rm +{{{H}}_{{2}}}{O(g)} \\ 起始量{\rm (mol)} & 1 & 3 & {} & 0 & 0 \\转化量 {\rm (mol)} & {1}\times {80 }\%{ =0}{.8} & {0}{.8}\times {3=2}{.4} & {} & {0}{.8} & {0}{.8} \\ 平衡量{\rm (mol)} & {1-0}{.8=0}{.2} & {3-2}{.4=0}{.6} & {} & {0}{.8} & {0}{.8} \\ \end{matrix}$,平衡常数${K=}\dfrac{{c(\rm C}{{{\rm H}}_{{3}}}{\rm OH)}\cdot {c(}{{{\rm H}}_{{2}}}{\rm O)}}{{c\rm (C}{{{\rm O}}_{{2}}}{)}\cdot {{{c}}^{{3}}}{(}{{\rm {H}}_{{2}}}{)}}$,${c=}\dfrac{{n}}{{V}}$,则${K=}\dfrac{\dfrac{{0}{.8}}{{2}}\times \dfrac{{0}{.8}}{{2}}}{\dfrac{{0}{.2}}{{2}}\times {{\left( \dfrac{{0}{.6}}{{2}} \right)}^{{3}}}}\approx {59}{.26}$。
③过程Ⅰ在${{{t}}_{{2}}}$时刻,$\rm {C}{{{O}}_{{2}}}$的转化率减小,平衡逆向移动,该反应为气体体积减小的放热反应,改变的反应条件可能是升高温度(或增大生成物浓度等合理答案)。
$\text{C}{{\text{O}}_{2}}$甲烷化是“负碳排放”的重要研究方向,某研究团队报道了镍基催化剂上$\text{C}{{\text{O}}_{2}}$与${{\text{H}}_{2}}$反应生成甲烷的两种机理如图所示,其中吸附在催化剂表面的物种用*表示。
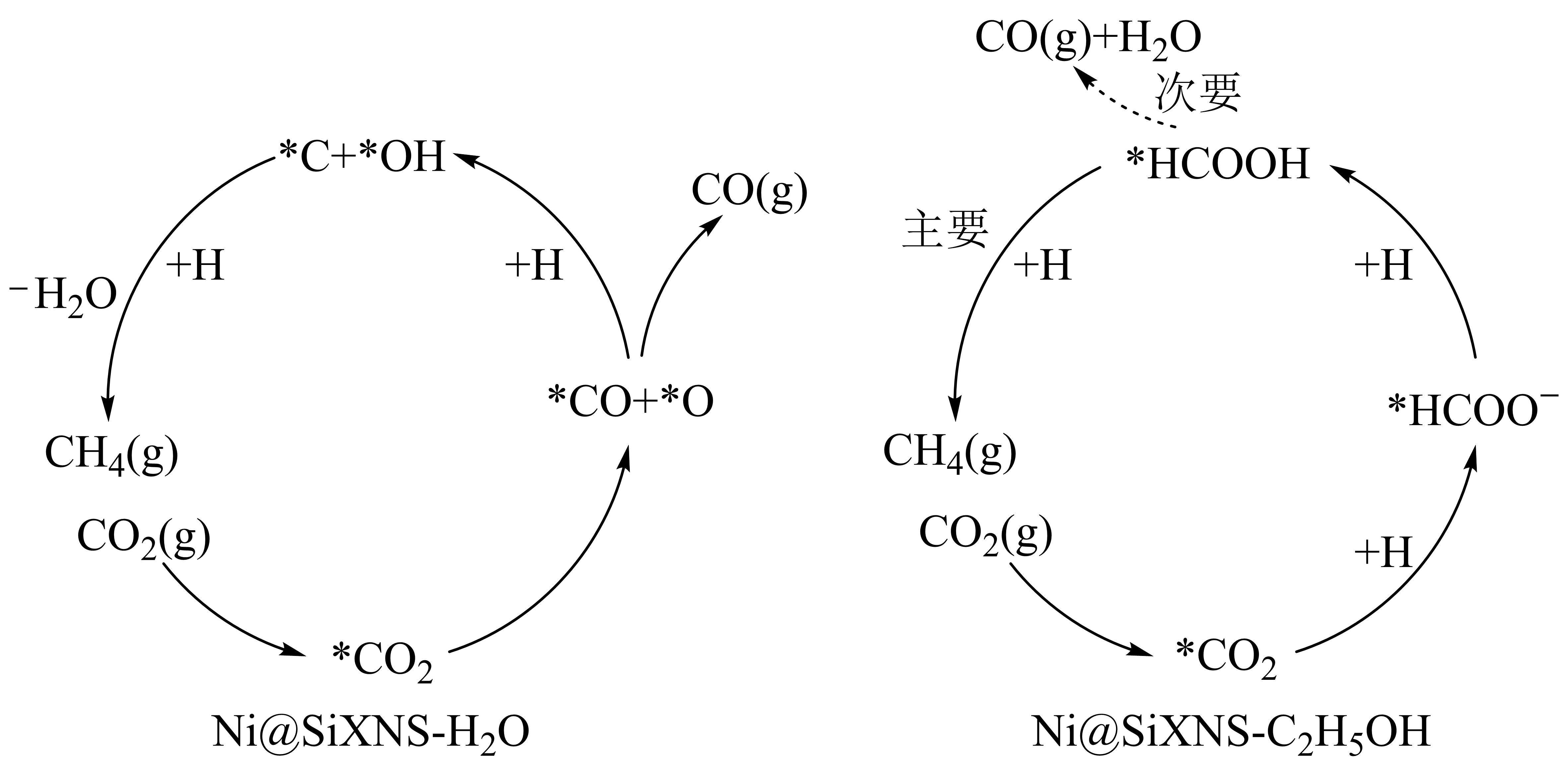
$\rm \mathrm{Ni} @ \mathrm{SiXNS}-\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}$机理中的产物的选择性 更高,$\rm \text{Ni}SiXNS-{{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}$机理中第二步反应可以表示为 。
$\\text{C}{{\\text{H}}_{\\text{4}}}$;$^{\\text{*}}\\text{C}{{\\text{O}}_{\\text{2}}}\\text{+H+}{{\\text{e}}^{-}}{{=}^{\\text{*}}}\\text{HCO}{{\\text{O}}^{-}}$
"]]①观察可知,在$\text{NiSiXNS - }{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH}$机理中,副反应较少,主要产物为甲烷,所以$\text{C}{{\text{H}}_{\text{4}}}$的选择性更高。
②在$\text{NiSiXNS }-{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}\text{OH}$机理中,第一步$\text{C}{{\text{O}}_{\text{2}}}$转化为$^{\text{*}}\text{C}{{\text{O}}_{\text{2}}}$,第二步根据图中箭头和物质变化,反应可表示为$^{\text{*}}\text{C}{{\text{O}}_{\text{2}}}\text{+H+}{{\text{e}}^{-}}{{=}^{\text{*}}}\text{HCO}{{\text{O}}^{-}}$
我国科学家采用单原子$\text{Ni}$和纳米$\text{Cu}$作串联催化剂,通过电解法将$\text{C}{{\text{O}}_{2}}$转化为乙烯,其装置如图所示。纳米$\text{Cu}$上发生的电极反应为 。
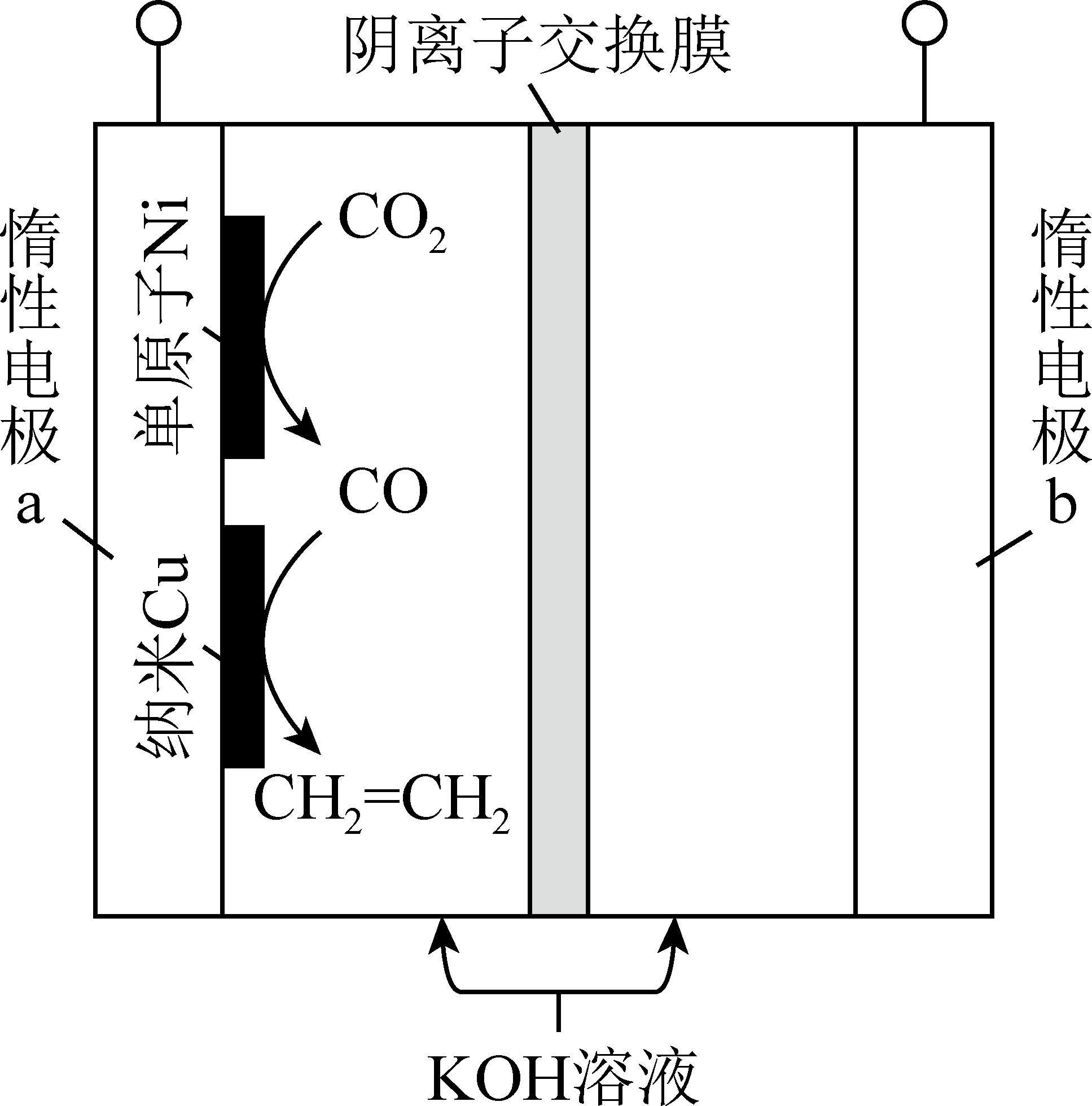
$2\\text{CO}+8{{\\text{e}}^{-}}+6{{\\text{H}}_{2}}\\text{O}={{\\text{C}}_{2}}{{\\text{H}}_{4}}+8\\text{O}{{\\text{H}}^{-}}$
"]]在电解池中,$\text{CO}$在纳米$\rm Cu$电极上发生还原反应生成乙烯,电解质溶液为$\rm KOH$溶液,根据电荷守恒和原子守恒,电极反应为$\text{2CO+8}{{\text{e}}^{-}}\text{+6}{{\text{H}}_{\text{2}}}\text{O=}{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}\text{+8O}{{\text{H}}^{-}}$。
高中 | 化学平衡常数题目答案及解析(完整版)
