高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
利用如图所示装置,可实现水体中$\text{NO}_{3}^{-}$的去除,$\rm ($已知${{\text{C}}_{6}}{{\text{H}}_{12}}{{\text{O}}_{6}}$中$\rm H$为$\rm +1$价,$\rm O$为$\rm -2$价$\rm )$。下列说法正确的是$(\qquad)$
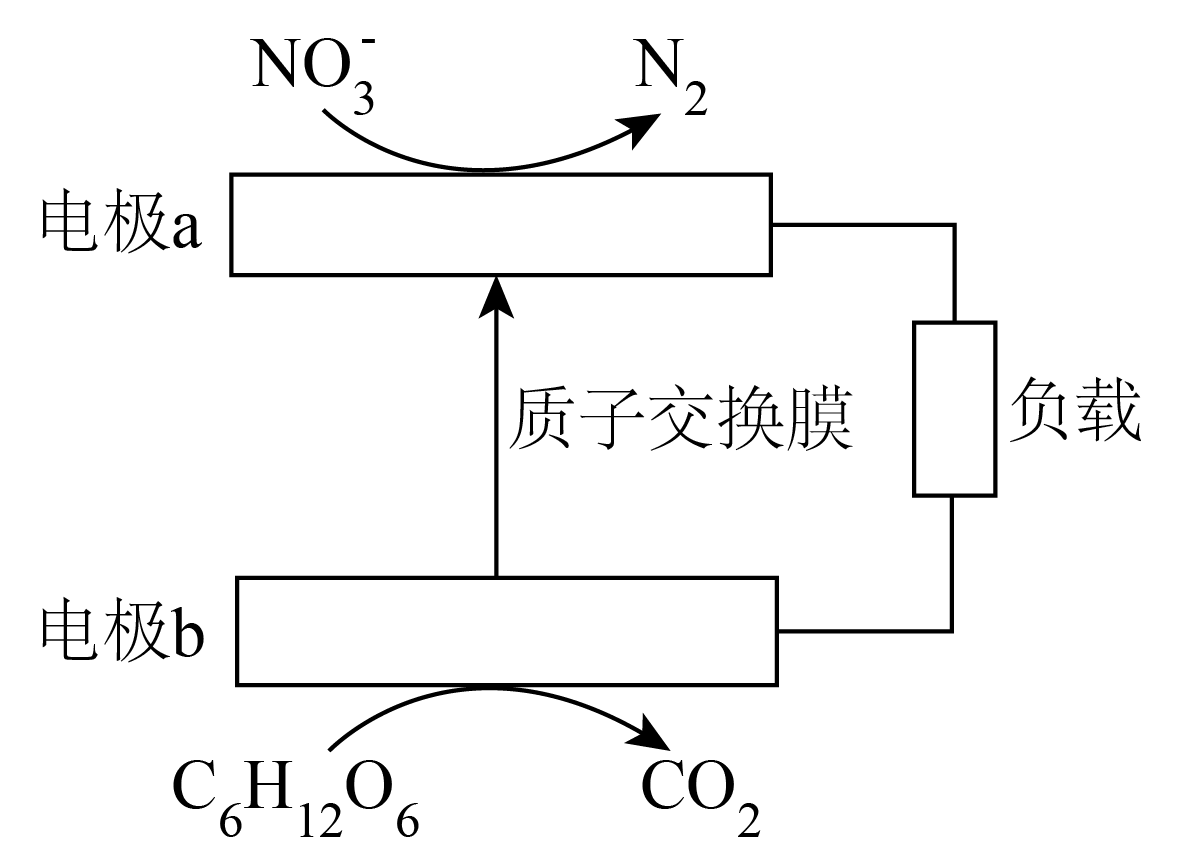
电极$\\rm a$的电极反应式为$\\rm 2\\text{NO}_{3}^{-}+10{{\\text{e}}^{-}}+12{{\\text{H}}^{+}}={{\\text{N}}_{2}}\\uparrow +6{{\\text{H}}_{2}}\\text{O}$
","电子从电极$\\rm b$经过负载到电极$\\rm a$再经过水溶液回到电极$\\rm a$
","产生$\\rm 1.25\\;\\rm mol\\;\\rm CO_{2}$,最多可处理$\\rm 2\\;\\rm mol\\text{ NO}_{3}^{-}$
","溶液中溶解氧气的浓度越大,越有利于$\\rm \\text{NO}_{3}^{-}$的除去
"]该装置为原电池装置,电极$\rm a$上$\rm N$元素化合价降低,发生还原反应,$\rm a$为正极,电极$\rm b$上$\rm C$元素化合价升高,发生氧化反应,$\rm b$为负极,据此解答。
$\rm A$.根据分析,$\rm a$为正极,电极反应式为:$\rm 2\text{NO}_{3}^{-}+10{{\text{e}}^{-}}+12{{\text{H}}^{+}}={{\text{N}}_{2}}\uparrow +6{{\text{H}}_{2}}\text{O}$,故$\rm A$正确;
$\rm B$.电子由负极$\rm b$流出沿导线流向正极$\rm a$,电子不能在溶液中迁移,故$\rm B$错误;
$\rm C$.产生$\rm 1.25\;\rm mol$ $\rm CO_{2}$,$\rm C$元素由$\rm 0$价升高为$\rm +4$价,转移$\rm 5\;\rm mol$电子,$\rm \text{NO}_{3}^{-}$转化为$\rm N_{2}$,$\rm N$元素由$\rm +5$价降低为$\rm 0$价,能处理$\rm 1\;\rm mol$,故$\rm C$错误;
$\rm D$.溶液中溶解氧气的浓度越大,正极氧气参与电极反应,不利于$\rm \text{NO}_{3}^{-}$的除去,故$\rm D$错误。
故选:$\rm A$
高中 | 原电池工作原理题目答案及解析(完整版)
