高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
Ⅰ.已知:$\rm H_{2}O_{2}$氧化$\rm HI$的反应是$\rm H_{2}O_{2}+2HI=I_{2}+2H_{2}O$;$\rm I_{2}$溶于水后,溶液呈棕黄色。某实验小组拟探究外界条件对$\rm H_{2}O_{2}$和$\rm HI$反应速率的影响,实验数据记录如下表:
| 实验序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| $c\rm (H_{2}O_{2})/mol/L$ | $\rm 0.1$ | $\rm 0.1$ | $\rm 0.1$ | $\rm 0.2$ | $\rm 0.3$ | $\rm 0.2$ |
| $c\rm (HI)/mol/L$ | $\rm 0.1$ | $\rm 0.2$ | $\rm 0.3$ | $\rm 0.1$ | $\rm 0.1$ | $c$ |
| 反应温度$\rm /^\circ\rm C$ | $\rm 25$ | $\rm 25$ | $\rm 25$ | $\rm 25$ | $\rm 25$ | $\rm 35$ |
| 从混合到出现棕黄色的时间$\rm /s$ | $\rm 13$ | $\rm 6.5$ | $\rm 4.3$ | $\rm 6.6$ | $\rm 4.4$ | $\rm t$ |
回答下列问题:
根据实验①~⑤的数据可以得出的结论是 。
其他条件相同的情况下,反应物浓度增大,反应速率增大
"]]实验①~⑤中反应物浓度不同,其他条件相同,比较①②③三组实验可知,随着$\rm HI$浓度增大,出现棕黄色的时间缩短,说明$\rm HI$浓度增大反应速率增大,比较①④⑤三组实验可知,随着过氧化氢浓度增大,出现棕黄色的时间缩短,说明过氧化氢浓度增大反应速率增大,结论为其他条件相同的情况下,反应物浓度增大,反应速率增大。
实验①经$\rm 20\;s$时测得$c\rm(H_{2}O_{2})=0.08\;\rm mol/L$,则$\rm 0-20\;s$内用$\rm HI$表示的平均反应速率$ v\rm(HI)=$ $\rm mol/(L·s)$。
$\\rm 0.002$
"]]实验①经$\rm 20\;s$时测得$c\rm(H_{2}O_{2})=0.08\;\rm mol/L$,则$v\rm(H_{2}O_{2})=\dfrac{0.02\;\rm \text{mol}/\text{L}}{20\;\text{s}}\rm =0.001\;\rm mol·L^{-1}·s^{-1}$。根据反应速率之比等于化学计量数之比,$v\rm(HI)= 0.002\;\rm mol·L^{-1}·s^{-1}$。
实验⑥中$ c=$ 。
$\\rm 0.1$
"]]从表中可知,实验⑥温度与其他组别不同,则实验⑥探究的是温度对反应速率的影响,则除了温度之外其他条件应该相同,故其对照组为实验④,$ c=0.1\;\rm mol/L$。
有人认为上述反应分两步进行:第$\rm 1$步反应为$\rm H_{2}O_{2}+HI=HIO+H_{2}O$,则第$\rm 2$步反应为 。
$\\rm HIO+HI=I_{2}+H_{2}O$
"]]总反应为$\rm H_{2}O_{2}+2HI=I_{2}+2H_{2}O$,第一步反应为$\rm H_{2}O_{2}+HI=HIO+H_{2}O$,则第二步反应$\rm =$总反应$\rm -$第一步反应,第二步反应为$\rm HIO+HI=I_{2}+H_{2}O$。
Ⅱ.白醋是日常饮食中的一种调味剂,国家标准规定酿造白醋中醋酸含量不得低于$\rm 0.035\;\rm g/mL$。用标准$\rm NaOH$溶液可以测定白醋中醋酸的浓度,以检测白醋是否符合国家标准,某品牌白醋的醋酸浓度测定过程如图所示,回答下列问题:
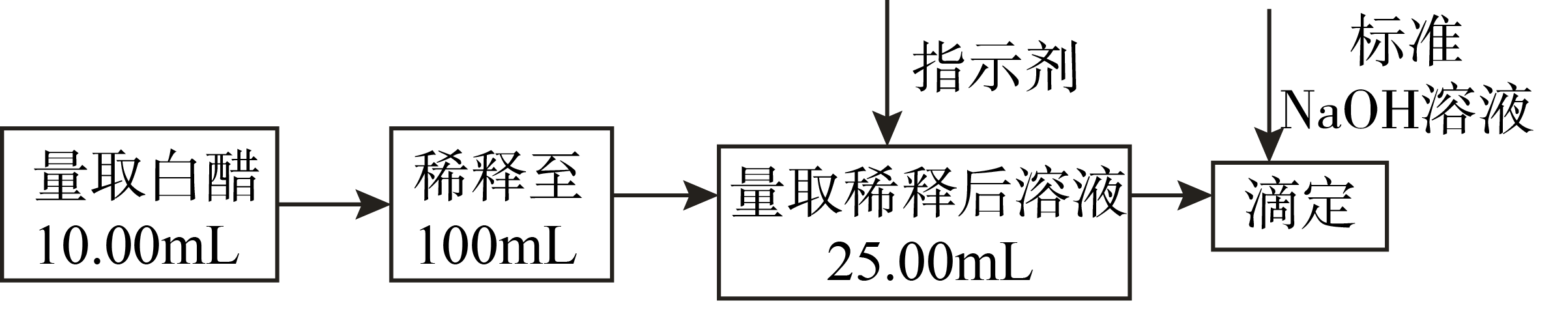
用 $\rm ($填仪器名称$\rm )$量取$\rm 25.00\;\rm mL$稀释后的白醋待测溶液到锥形瓶中,向其中滴加$\rm 2$滴 作指示剂$\rm ($填“酚酞”“甲基橙”或“石蕊”$\rm )$。
酸式滴定管 酚酞
"]]白醋为酸溶液,用酸式滴定管量取$\rm 25.00\;\rm mL$稀释后的白醋待测液到锥形瓶中。用标准$\rm NaOH$溶液滴定醋酸溶液,滴定终点时溶液为弱碱性,选择酚酞为指示剂,则滴定终点时溶液由无色变为浅红色,现象明显,故选:择酚酞为指示剂,石蕊变色范围太宽且颜色变化不明显,一般不用做指示剂,甲基橙在$\rm pH$大于$\rm 4.4$时就呈黄色,变黄色时溶液可能还是酸性,没有达到滴定终点。
用标准的$\rm 0.0600\;\rm mol/L\;NaOH$溶液滴定上述稀释后的白醋溶液,滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积$\rm /mL$ | 标准溶液的体积 | |
| 滴定前刻度$\rm /mL$ | 滴定后刻度$\rm /mL$ | ||
| $\rm 1$ | $\rm 25.00\;\rm mL$ | $\rm 0.12$ | $\rm 25.11$ |
| $\rm 2$ | $\rm 25.00\;\rm mL$ | $\rm 0.30$ | $\rm 25.31$ |
| $\rm 3$ | $\rm 25.00\;\rm mL$ | $\rm 0.80$ | $\rm 25.80$ |
| $\rm 4$ | $\rm 25.00\;\rm mL$ | ||
第$\rm 4$次滴定实验开始和结束时,碱式滴定管中的液面如图所示:
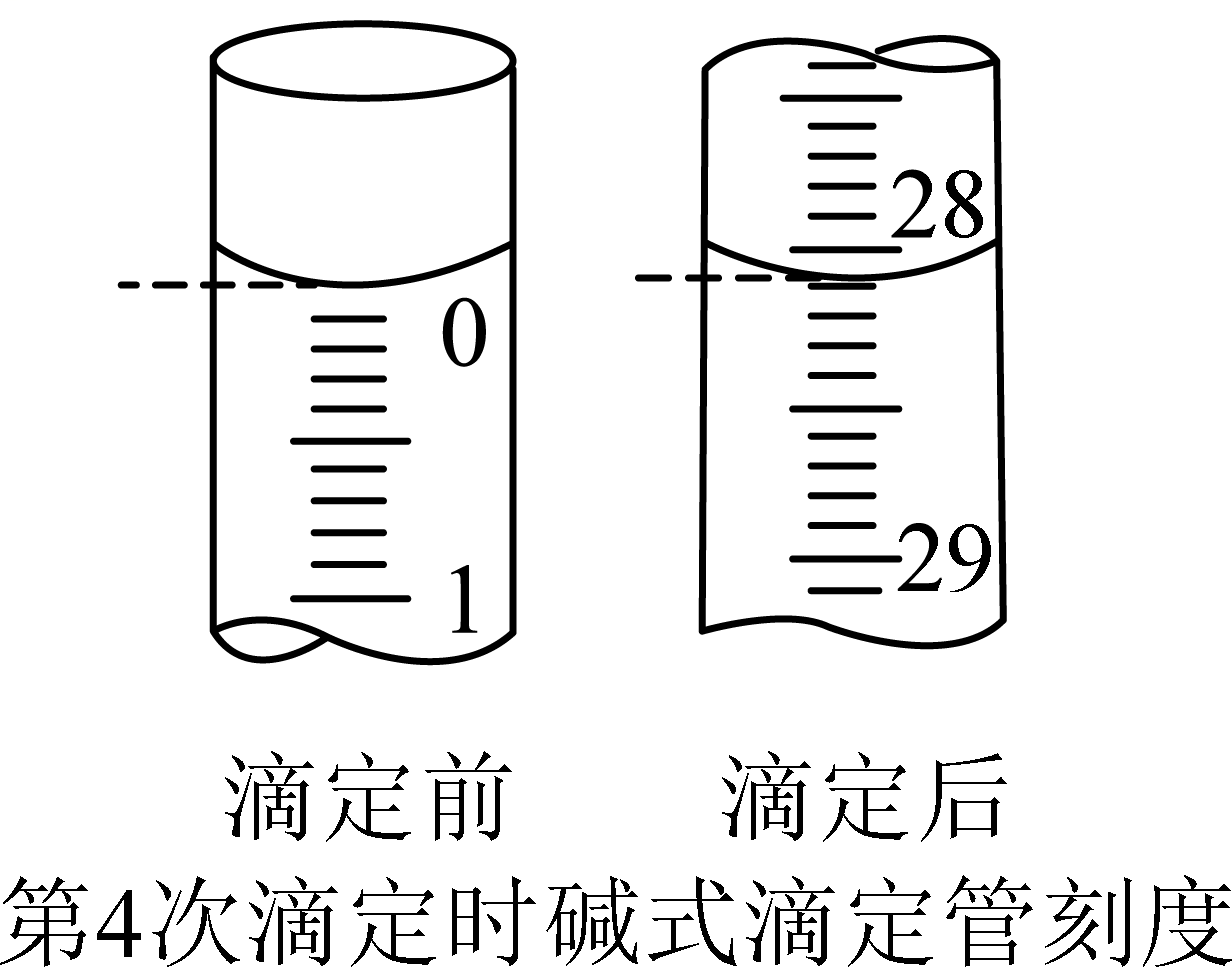
根据上述实验数据计算该白醋中醋酸含量为 $\rm g/mL$。
$\\rm 0.036$
"]]根据图示可知,滴定前刻度为$\rm 0\;\rm mL$,滴定后刻度为$\rm 28.10\;\rm mL$,第四组数据与另外三组数据偏差较大舍去,则平均消耗氢氧化钠的体积为$\rm 25\;\rm mL$,氢氧化钠的物质的量为$\rm 0.06\;\rm mol/L$,白醋的体积为$\rm 25\;\rm mL$,且醋酸与$\rm NaOH$按照物质的量$\rm 1: 1$进行反应,则醋酸的浓度为$\rm 0.06\;\rm mol/L$,该白醋中醋酸含量为$\dfrac{0.06\;\rm \text{mol}\times 60\;\text{g/mol}\times \text{10}}{1000\;\rm \text{mL}}\rm =0.036\;\rm g/mL$。
下列操作中,可能使所测白醋中醋酸的浓度数值偏高的是$(\quad\ \ \ \ )\rm ($填序号$\rm )$。
碱式滴定管未用标准$\\rm NaOH$溶液润洗就直接注入标准$\\rm NaOH$溶液
","滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
","滴定过程中振摇时有待测液滴溅出来
","读取$\\rm NaOH$溶液体积时,开始时仰视读数,滴定结束时俯视读数
","碱式滴定管在滴定前有气泡,滴定后气泡消失
"]$\rm A$,碱式滴定管未用标准$\rm NaOH$溶液润洗就直接注入标准$\rm NaOH$溶液,导致$\rm NaOH$溶液的浓度偏低,消耗$\rm NaOH$体积偏大,测得醋酸浓度偏高,$\rm A$正确;
$\rm B$.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥,对滴定没有影响,$\rm B$错误;
$\rm C$.滴定过程中振摇时有待测液滴溅出来,导致部分醋酸损失,消耗的$\rm NaOH$溶液的体积偏小,测得醋酸浓度偏低,$\rm C$错误;
$\rm D$.读取$\rm NaOH$溶液体积时,开始时仰视读数,滴定结束时俯视读数,使得计算所得$\rm NaOH$消耗的体积偏小,测得醋酸浓度偏低,$\rm D$错误;
$\rm E$.碱式滴定管滴定前有气泡,滴定后气泡消失,则计算所得$\rm NaOH$溶液消耗的体积偏大,测得醋酸浓度偏高,$\rm E$正确;
故答案选$\rm A\rm E$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
