高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
硫酸化焙烧法处理某铜阳极泥$\rm [$主要成分为铜、硒化亚铜$\rm (C{{u}_{2}}Se)$和碲化亚铜$\rm (C{{u}_{2}}Te)$等$\rm ]$是回收硒$\rm (Se)$、碲$\rm (Te)$最常用的工艺之一,其流程如下:
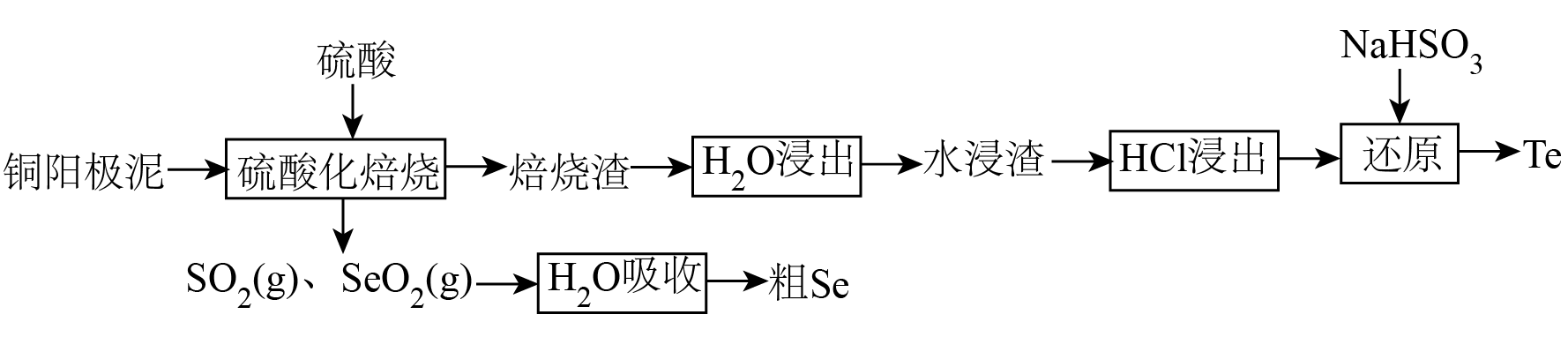
已知:①$\rm Se$和$\rm Te$为同主族相邻周期的元素,性质有相似性。
②$\rm Te{{O}_{2}}$微溶于水。
$\rm Te$的价层电子排布式为 。
$\\rm 5{{s}^{2}}5{{p}^{4}}$
"]]$\rm Te$是第五周期Ⅵ$\rm A$族元素,价层电子排布式为$\rm 5{{s}^{2}}5{{p}^{4}}$。
写出“硫酸化焙烧”时$\rm C{{u}_{2}}Se$和硫酸反应生成$\rm S{{O}_{2}}$、$\rm Se{{O}_{2}}$的化学方程式 。
$\\rm C{{u}_{2}}Se+6{{H}_{2}}S{{O}_{4}}\\begin{matrix} \\underline{\\underline{\\triangle }} \\\\ {} \\\\ \\end{matrix}2CuS{{O}_{4}}+Se{{O}_{2}}\\uparrow +4S{{O}_{2}}\\uparrow +6{{H}_{2}}O$
"]]“硫酸化焙烧”时$\rm C{{u}_{2}}Se$和硫酸反应生成$\rm CuSO_{4}$、$\rm S{{O}_{2}}$、$\rm Se{{O}_{2}}$,$\rm Cu$元素化合价由$\rm +1$升高为$\rm +2$、$\rm Se$元素化合价由$\rm -2$升高为$\rm +4$,$\rm S$元素化合价由$\rm +6$降低为$\rm +4$,根据得失电子守恒,反应的化学方程式为$\rm C{{u}_{2}}Se+6{{H}_{2}}S{{O}_{4}}\begin{matrix} \underline{\underline{\triangle }} \\ {} \\ \end{matrix}2CuS{{O}_{4}}+Se{{O}_{2}}\uparrow +4S{{O}_{2}}\uparrow +6{{H}_{2}}O$。
“$\rm {{H}_{2}}O$吸收”生成的 可以循环利用,反应消耗的氧化剂和还原剂的物质的量之比是 。
硫酸$\\rm ($或$\\rm {{H}_{2}}S{{O}_{4}})$;$\\rm 1:2$
"]]“$\rm {{H}_{2}}O$吸收”$\rm S{{O}_{2}}$、$\rm Se{{O}_{2}}$发生反应$\rm 2SO_{2}+SeO_{2}+2H_{2}O=Se+2H_{2}SO_{4}$,生成的硫酸可以循环到“硫酸化焙烧”利用,二氧化硒是氧化剂,二氧化硫是还原剂,反应消耗的氧化剂和还原剂的物质的量之比是$\rm 1:2$。
$\rm C{{u}_{2}}Te$和硫酸的反应类似$\rm C{{u}_{2}}Se$和硫酸的反应,则焙烧渣的主要成分是 、 ;验证“水浸渣”洗涤干净的方法:取最后的洗涤液少许于试管中,先加稀$\rm HCl$酸化,再加入 溶液,若无明显现象,说明浸渣洗涤干净。
$\\rm CuS{{O}_{4}}$;$\\rm Te{{O}_{2}}$;$\\rm BaC{{l}_{2}}$
"]]“硫酸化焙烧”时$\rm C{{u}_{2}}Se$和硫酸反应生成$\rm CuSO_{4}$、$\rm S{{O}_{2}}$、$\rm Se{{O}_{2}}$,$\rm Cu_{2}Te$被氧化生成$\rm CuSO_{4}$、$\rm TeO_{2}$、$\rm SO_{2}$,则焙烧渣的主要成分是$\rm CuS{{O}_{4}}$、$\rm Te{{O}_{2}}$;“水浸渣”中可能含有的杂质是硫酸铜,若洗涤液中不含硫酸根离子,说明“水浸渣”洗涤干净,验证“水浸渣”洗涤干净的方法:取最后的洗涤液少许于试管中,先加稀$\rm HCl$酸化,再加入$\rm BaC{{l}_{2}}$溶液,若无明显现象,说明浸渣洗涤干净。
“$\rm HCl$浸出”生成$\rm TeC{{l}_{4}}$溶液$\rm ($碲元素以$\rm T{{e}^{4+}}$的形式存在$\rm )$,写出“还原”的离子方程式 。
$\\rm T{{e}^{4+}}+2HSO_{3}^{-}+2{{H}_{2}}O=Te+6{{H}^{+}}+2SO_{4}^{2-}$
"]]“$\rm HCl$浸出”生成$\rm TeC{{l}_{4}}$溶液$\rm ($碲元素以$\rm T{{e}^{4+}}$的形式存在$\rm )$,“还原”时,亚硫酸氢钠和$\rm TeC{{l}_{4}}$反应生成硫酸钠、$\rm Te$、硫酸、盐酸,反应的离子方程式$\rm T{{e}^{4+}}+2HSO_{3}^{-}+2{{H}_{2}}O=Te+6{{H}^{+}}+2SO_{4}^{2-}$。
$\rm Te$粉中$\rm Te$质量分数的测定,步骤如下:
①取$\rm 5.0\ g\ Te$粉,加入某酸使其转化为亚碲酸$\rm ({{H}_{2}}Te{{O}_{3}})$,将其配制成$\rm 100\ mL$溶液,取$\rm 20.00\ mL$溶液于锥形瓶中。
②往锥形瓶中加入$\rm 20\ mL\ 0.10\ mol\cdot {{L}^{-1}}$酸性$\rm {{K}_{2}}C{{r}_{2}}{{O}_{7}}$溶液,充分反应使亚碲酸转化为碲酸$\rm ({{H}_{6}}Te{{O}_{6}})$。
③往锥形瓶中加入指示剂,用$\rm 0.10 \ {mol} \cdot {L}^{-1}$硫酸亚铁铵$\rm \left[ {{(N{{H}_{4}})}_{2}}Fe{{(S{{O}_{4}})}_{2}} \right]$标准溶液滴定剩余的酸性$\rm {{K}_{2}}C{{r}_{2}}{{O}_{7}}$溶液,进行三次平行实验,平均消耗$\rm 12.00\ mL$硫酸亚铁铵标准溶液。试计算$\rm Te$粉中$\rm Te$的质量分数为 。
$\\rm 69.12\\%$
"]]酸性$\rm {{K}_{2}}C{{r}_{2}}{{O}_{7}}$溶液把亚碲酸转化为碲酸$\rm ({{H}_{6}}Te{{O}_{6}})$,根据得失电子守恒建立反应关系式$\rm {{K}_{2}}C{{r}_{2}}{{O}_{7}}\sim 3H_{2}TeO_{3}\sim 3Te$;酸性$\rm {{K}_{2}}C{{r}_{2}}{{O}_{7}}$溶液把$\rm {{(N{{H}_{4}})}_{2}}Fe{{(S{{O}_{4}})}_{2}}$中$\rm Fe^{2+}$氧化为$\rm Fe^{3+}$,根据得失电子守恒建立反应关系式$\rm {{K}_{2}}C{{r}_{2}}{{O}_{7}}\sim \sim \sim 6{{(N{{H}_{4}})}_{2}}Fe{{(S{{O}_{4}})}_{2}}$,$\rm {{(N{{H}_{4}})}_{2}}Fe{{(S{{O}_{4}})}_{2}}$消耗$\rm {{K}_{2}}C{{r}_{2}}{{O}_{7}}$的物质的量为$\rm \dfrac{1}{6}\times 0.012\ L\times 0.1\ mol/L=0.0002\ mol$,则$\rm H_{2}TeO_{3}$消耗$\rm {{K}_{2}}C{{r}_{2}}{{O}_{7}}$的物质的量为$\rm 0.02\ L\times 0.1\ mol/L-0.0002\ mol=0.0018\ mol$,$n{\rm (H_{2}TeO_{3})}=n{\rm (Te)}=0.0018\rm \ mol\times 3=0.0054\ mol$,$\rm Te$粉中$\rm Te$的质量分数为$\rm \dfrac{128\ g/mol\times 0.0054\ mol\times \dfrac{100}{20}}{5\ g}\times 100\%=69.12\%$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
