高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
我国力争$\rm 2060$年前实现碳中和,$\text{C}{{\text{O}}_{2}}$的资源化利用具有重要意义。
钙循环捕集$\text{C}{{\text{O}}_{2}}$与$\rm CaO/\text{Ca}{{\left( \text{OH} \right)}_{2}}$储热体系耦合工艺
以石灰石为原料的钙循环耦合工艺流程如图所示。
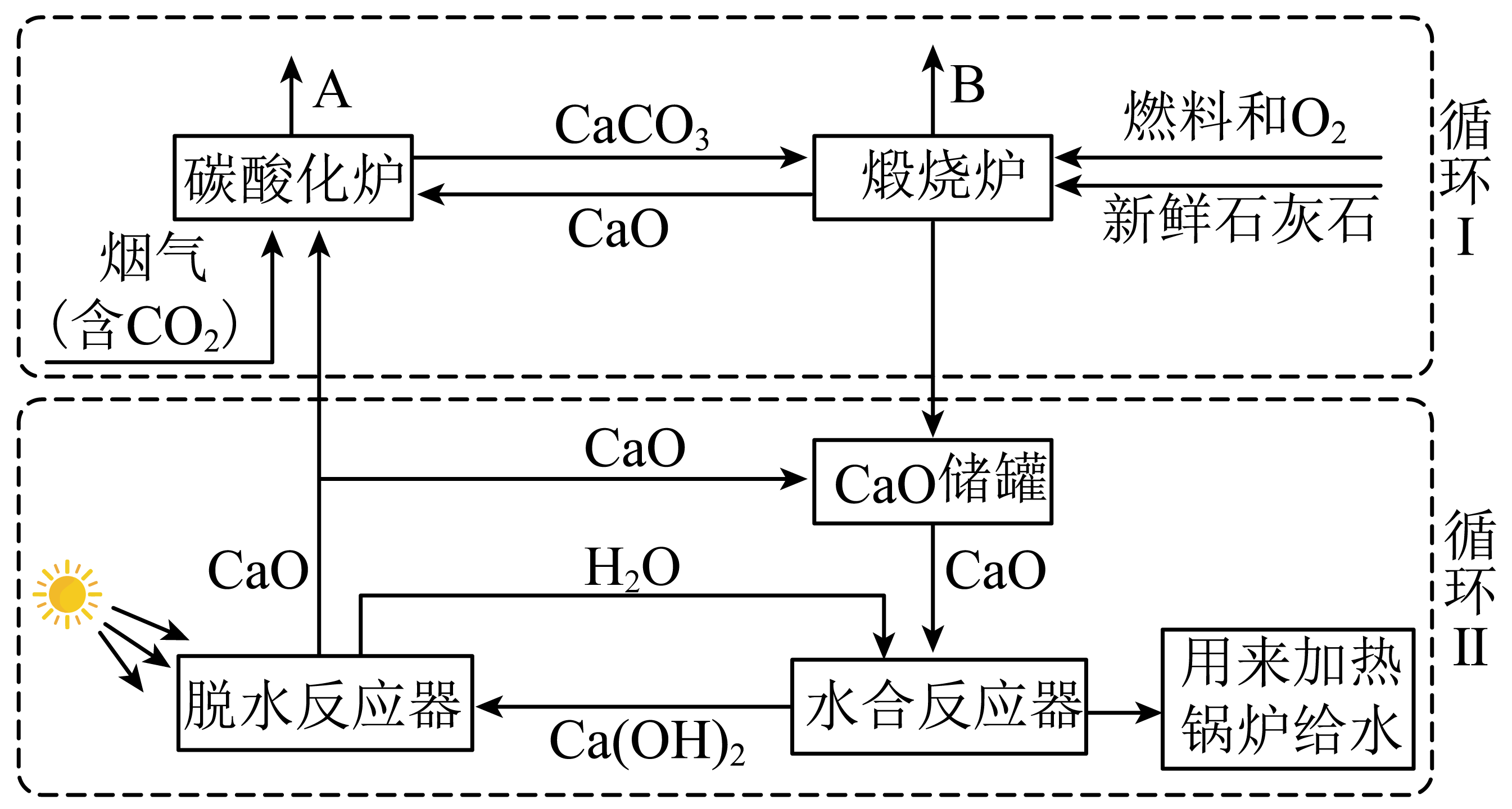
①循环$\rm I$中,$\text{C}{{\text{O}}_{2}}$含量较高的是 $\rm ($填“$\rm A$”或“$\rm B$”$\rm )$处。
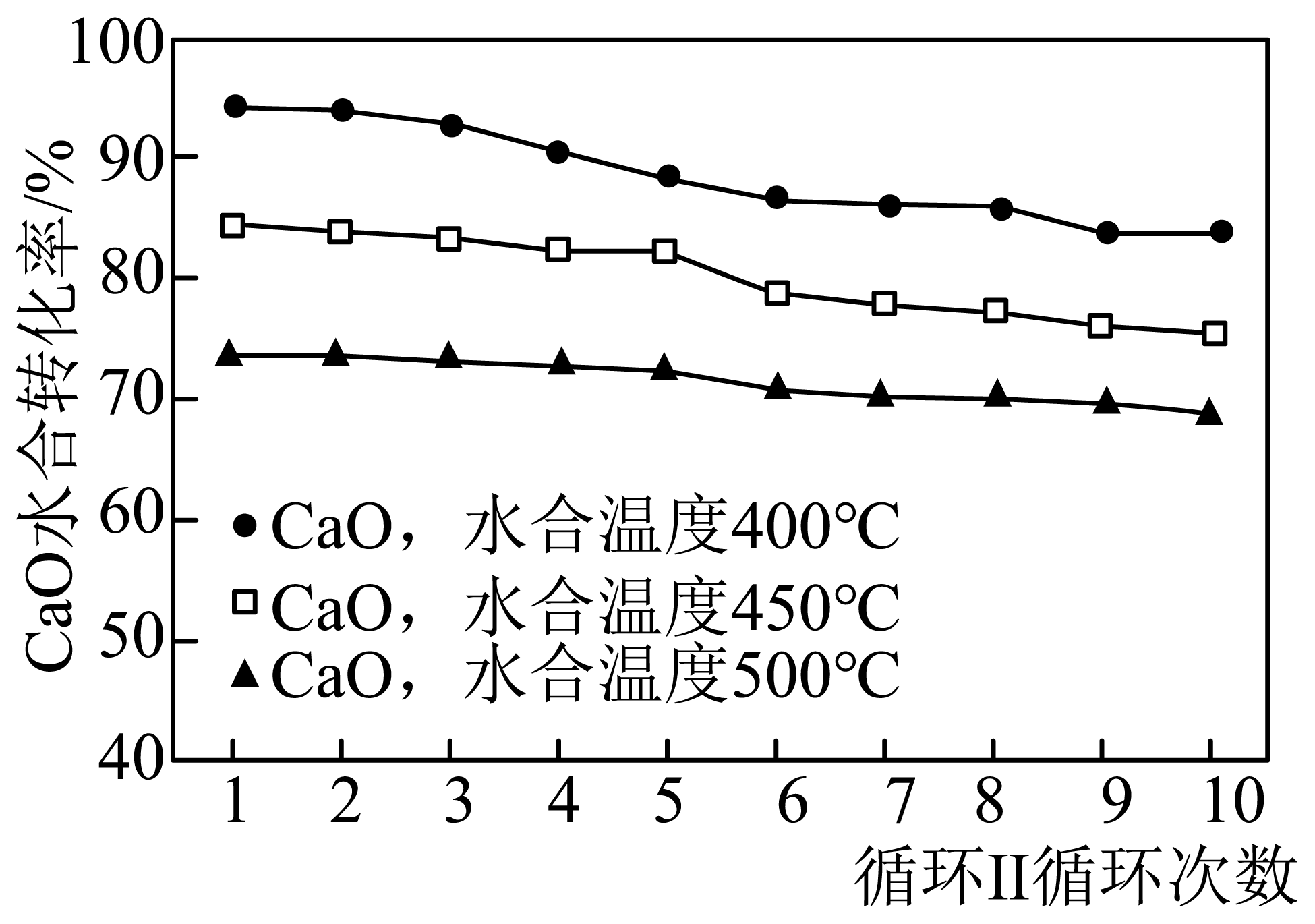
②若仅进行循环$\rm II$,控制不同水合温度反应相同时间,水合反应器中水合温度对$\rm CaO$水合转化率的影响如题图所示,在最佳水合温度下发生反应的化学方程式为 。
③经历多次循环$\rm I$后,高温煅烧造成$\rm CaO$孔隙大量减少,捕集$\text{C}{{\text{O}}_{2}}$效率降低。分析经历多次循环$\rm I$再经历多次循环$\rm II$后的$\rm CaO$能有效提高$\text{C}{{\text{O}}_{2}}$捕集效率的可能原因是 。
④从能量转化与物质资源综合利用角度分析,该工艺的优点是 。
$\\rm B$ ; $\\text{CaO+}\\text{H}_{\\text{2}}\\text{O}\\begin{matrix}\\underline{\\underline{400\\ ^{\\circ}\\text{C}}}\\\\\\\\\\end{matrix}\\text{Ca(OH}\\text{)}_{_{\\text{2}}}$ ;循环$\\rm II$中的脱水反应器中会产生大量的水蒸气,水蒸气在$\\rm CaO$中进行无规则运动,使$\\rm CaO$孔隙大量增加,所以捕集$\\text{C}{{\\text{O}}_{2}}$效率增大; 节省能源,原子利用率高,对环境友好
"]]①“煅烧炉”中,石灰石高温分解产生$\text{C}{{\text{O}}_{\text{2}}}$和$\rm CaO$,“碳酸化炉”是吸收$\text{C}{{\text{O}}_{\text{2}}}$,所以$\text{C}{{\text{O}}_{2}}$含量较高的是$\rm B$处;
②由图可知,$\rm 400\;\rm ^\circ\rm C$时,$\rm CaO$水合转化率最高,所以在最佳水合温度下发生反应的化学方程式为$\text{CaO+}\text{H}_{\text{2}}\text{O}\begin{matrix}\underline{\underline{400\ ^{\circ}\text{C}}}\\\\\end{matrix}\text{Ca(OH}\text{)}_{_{\text{2}}}$;
③循环$\rm II$中的脱水反应器中会产生大量的水蒸气,水蒸气在$\rm CaO$中进行无规则运动,使$\rm CaO$孔隙大量增加,所以捕集$\text{C}{{\text{O}}_{2}}$效率增大;
④根据流程图可知仅“煅烧炉”需要消耗较多能量,其余流程中几乎无能量消耗,且还会给外界供给能量;从物质角度看,该工艺原子利用率较高,产生的$\text{C}{{\text{O}}_{2}}$能循环使用,减少了排出量,$\rm CaO$的利用率很高,几乎没有损耗;所以该工艺的优点是节省能源,原子利用率高,对环境友好;
利用光催化还原$\text{C}{{\text{O}}_{2}}$制$\rm HCOOH$等液态燃料
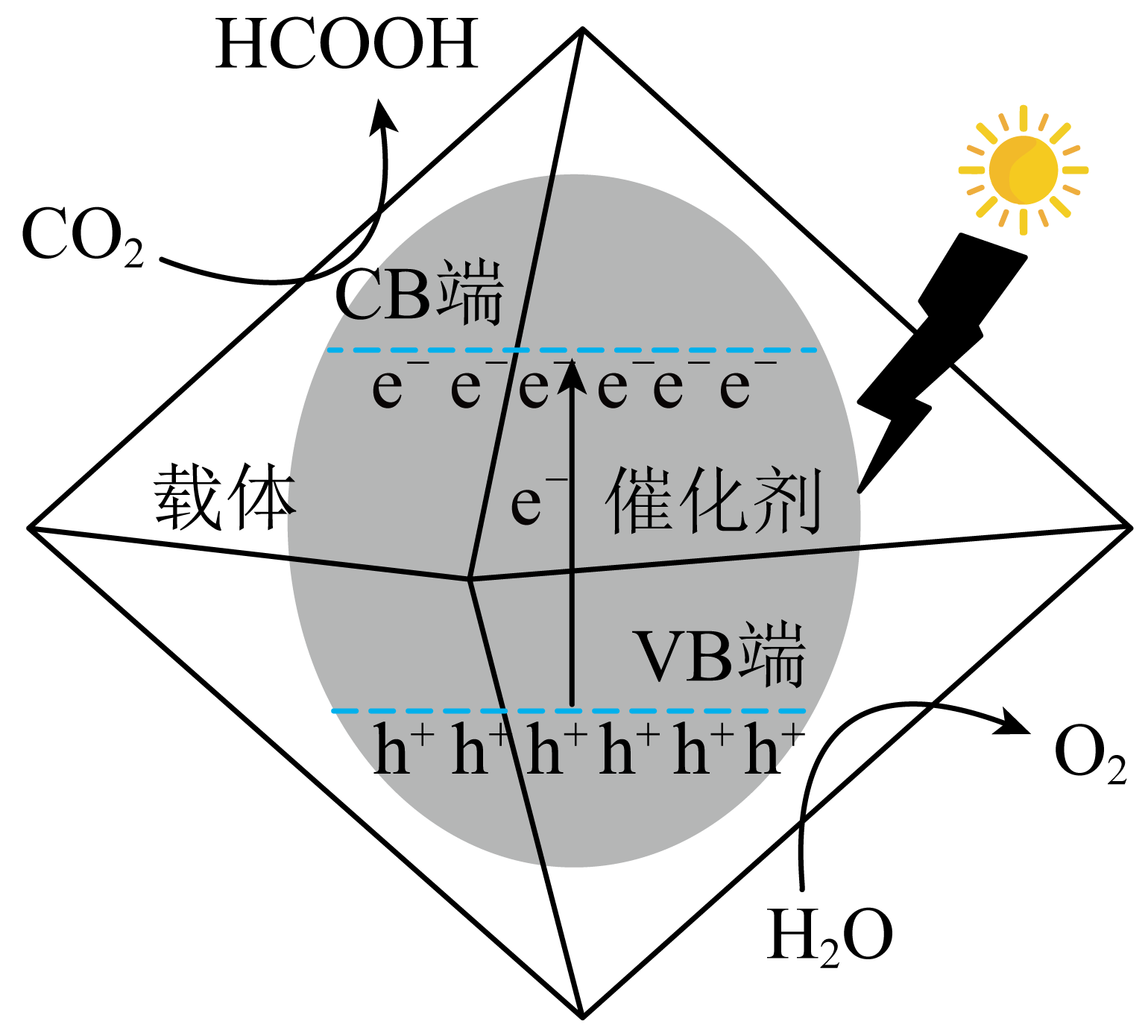
光催化过程包括催化剂的光激发、光生电子$\rm ({{\text{e}}^{-}}\rm )$与缺电子空穴$\rm ({{\text{h}}^{+}}\rm )$的分离或复合、光生电子的迁移及后续的氧化与还原反应。
①光催化还原$\text{C}{{\text{O}}_{2}}$制备$\rm HCOOH$的原理如图所示,该过程机理可描述为 。
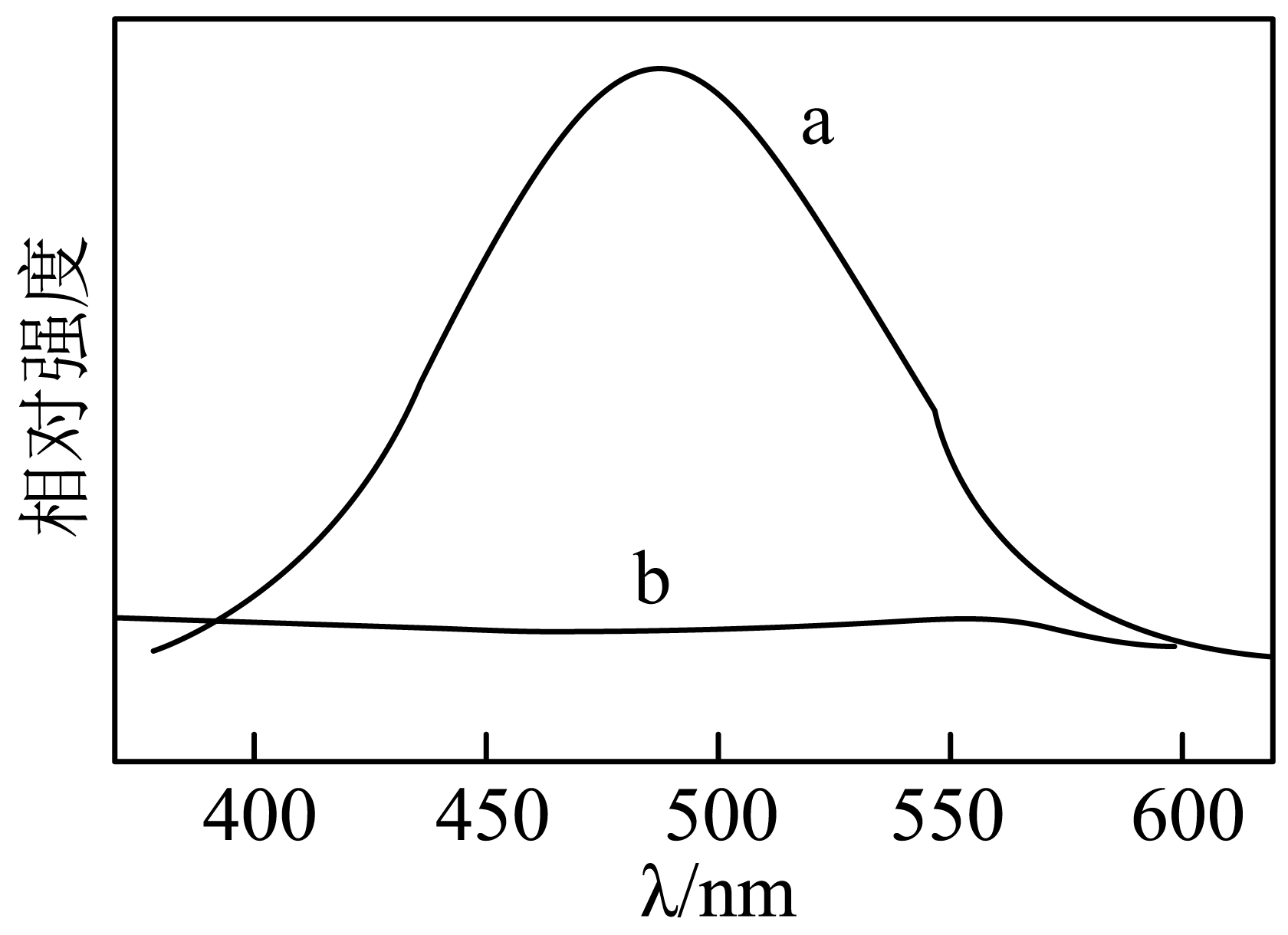
②催化剂对光的吸收强度是影响其光催化性能的重要因素之一。荧光强度越强,光生电子和空穴复合几率越大。催化剂$\rm a$和$\rm b$的荧光光谱如图所示,请判断哪一种催化剂催化效果更好,并说明理由 。
$\\text{C}{{\\text{O}}_{\\text{2}}}\\text{+2}{{\\text{H}}^{+}}\\text{+2}{{\\text{e}}^{-}}\\text{=HCOOH}$ ; $\\rm b$
"]]①由图可知,$\text{C}{{\text{O}}_{2}}$得电子反应生成$\rm HCOOH$,该过程机理可描述为$\text{C}{{\text{O}}_{\text{2}}}\text{+2}{{\text{H}}^{+}}\text{+2}{{\text{e}}^{-}}\text{=HCOOH}$;
②由图可知光生电子$\rm ({{\text{e}}^{-}}\rm )$与缺电子空穴$\rm ({{\text{h}}^{+}}\rm )$需要较好的分离,各自才能起到对应的作用,因为荧光强度越强,光生电子和空穴复合几率越大,所以催化剂催化效果更好为$\rm b$;
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
