高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
化学还原稳定法是当前$\rm Cr($Ⅵ$)$水体污染修复领域的主要技术。废水中$\rm Cr($Ⅵ$)$主要以$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$和$\text{CrO}_{\text{4}}^{\text{2-}}$形式存在,化学还原稳定法去除水中$\rm Cr($Ⅵ$)$主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。
难溶于水的$\rm CaS_{5}$是常用的硫系还原剂,在处理$\rm Cr($Ⅵ$)$时自身转化为单质$\rm S$。在酸性溶液中,$\rm CaS_{5}$还原$\rm Cr($Ⅵ$)$的离子方程式为 。
$\\rm 3CaS_{5}+\\text{C}{{\\text{r}}_{\\text{2}}}\\text{O}_{\\text{7}}^{\\text{2-}}\\rm +14H^{+}=$ $\\rm 2Cr^{3+}+15S+3Ca^{2+}+7H_{2}O$
"]]根据题意可知$\text{Ca}{{\text{S}}_{5}}$修复时发生反应,$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}\text{+3Ca}{{\text{S}}_{\text{5}}}\text{+14}{{\text{H}}^{+}}\text{=2C}{{\text{r}}^{\text{3+}}}\text{+3C}{{\text{a}}^{\text{2+}}}\text{+15S+7}{{\text{H}}_{\text{2}}}\text{O}$;
铁系还原剂$\rm FeSO_{4}$的还原效率虽不及硫化物,但有利于$\rm Cr$的固定。 $\rm Cr$的固定途径有两个:其一是难溶性铬铁共沉淀氢氧化物$\rm [Cr_{\textit{x}}Fe_{1-\textit{x}}(OH)_{3}]$或$\rm Cr(OH)_{3}$沉淀的生成;其二是 。
$\\rm Fe^{3+}$水解产生的$\\rm Fe(OH)_{3}$胶体吸附$\\text{C}{{\\text{r}}_{\\text{2}}}\\text{O}_{\\text{7}}^{\\text{2-}}$或$\\text{CrO}_{\\text{4}}^{\\text{2-}}$
"]]溶液中生成三价铁后,三价铁可以水解生成氢氧化铁胶体,可以吸附含有铬元素的微粒,$\text{C}{{\text{r}}_{\text{2}}}\text{O}_{\text{7}}^{\text{2-}}$或$\text{CrO}_{\text{4}}^{\text{2-}}$;
试剂联用$\rm [\textit{n}(CaS_{5})$∶$\rm \textit{n}(FeSO_{4})=1$∶$\rm 2]$有望实现高效且稳定的修复效果。
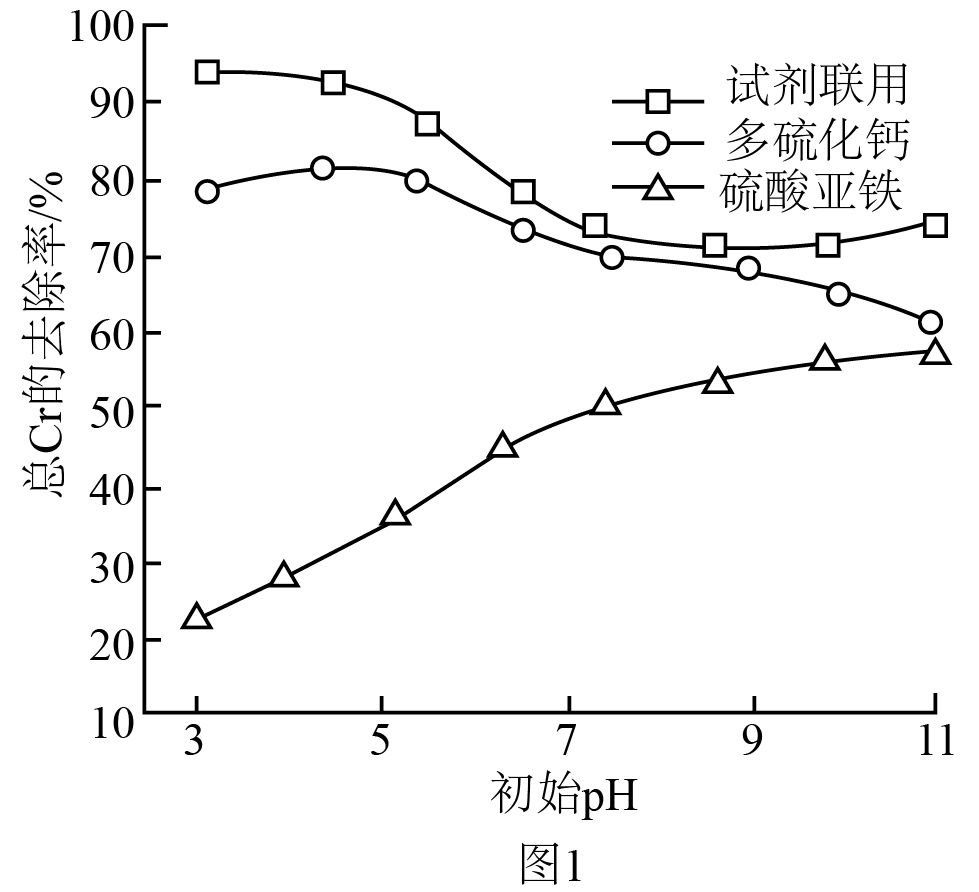
①待各体系充分反应后,静置$\rm 2\;\rm h$。实验测得分别使用单一试剂和试剂联用时,溶液中总$\rm Cr$的去除率随溶液初始$\rm pH$的变化关系如图$\rm 1$所示。$\rm pH\gt 9$,随$\rm pH$增大,试剂联用时溶液中总$\rm Cr$的去除率上升的原因是 。
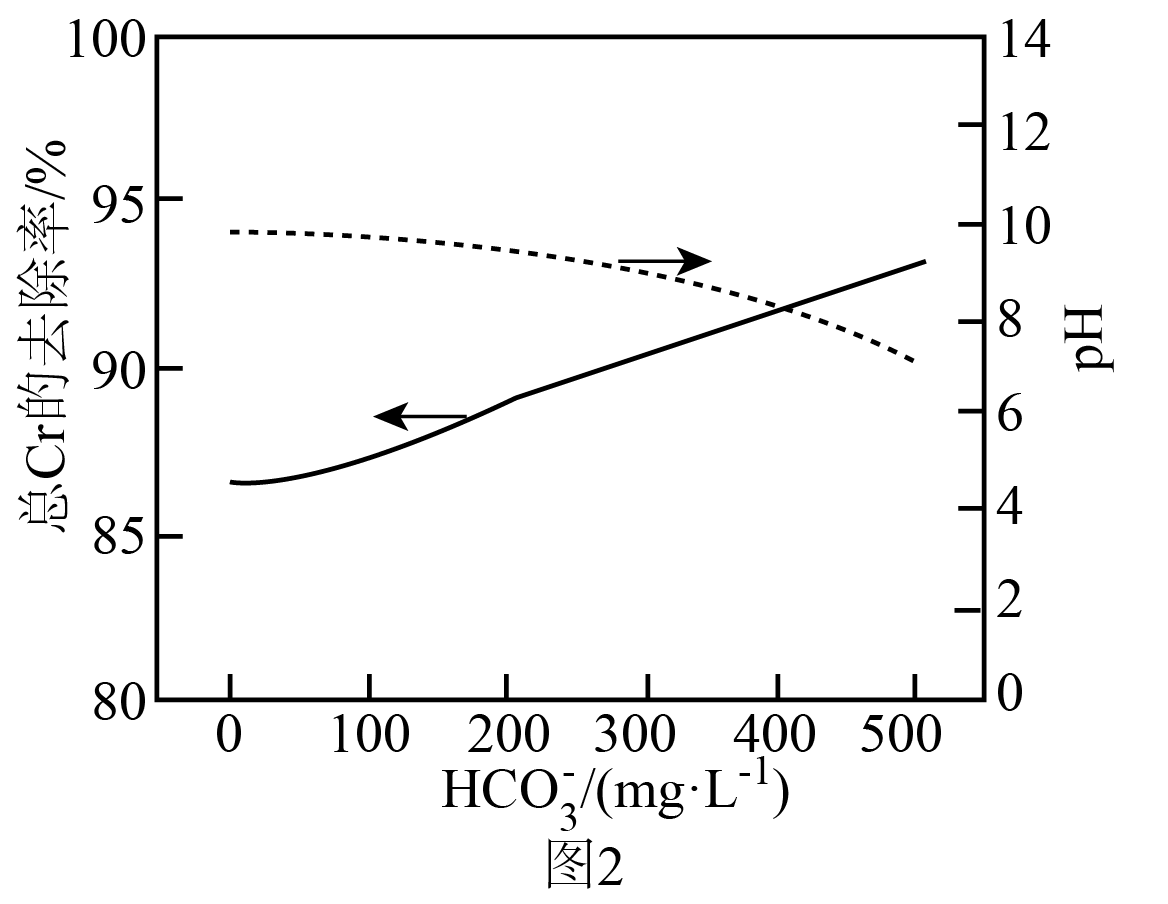
②在$\text{HCO}_{\text{3}}^{-}$存在下,试剂联用处理溶液中$\rm Cr($Ⅵ$)$,待体系充分反应,静置$\rm 2\;\rm h$。测得$\text{HCO}_{\text{3}}^{-}$浓度对溶液$\rm pH$以及总$\rm Cr$去除效果的影响关系如图$\rm 2$所示。随$\text{HCO}_{\text{3}}^{-}$浓度进一步增加,总$\rm Cr$的去除率明显上升的原因是 。
③研究表明,试剂联用效果优于单一试剂主要是由于反应过程中生成了起催化作用的$\rm FeS$。$\rm FeS$的生成过程可用化学方程式表示为 。
$\\rm pH$增大,使用$\\rm CaS_{5}$会抑制$\\rm Cr($Ⅵ$)$的还原,降低总$\\rm Cr$去除率,但使用$\\rm FeSO_{4}$有利于$\\rm Cr($Ⅵ$)$的固定,提高总$\\rm Cr$去除率,试剂联用时,$\\rm FeSO_{4}$的用量大于$\\rm CaS_{5}$,增大$\\rm pH$,$\\rm FeSO_{4}$对总$\\rm Cr$去除率的影响程度大于$\\rm CaS_{5}$ ;增大$\\text{HCO}_{\\text{3}}^{-}$浓度,溶液$\\rm pH$减小,试剂联用时低$\\rm pH$值有利于$\\rm Cr($Ⅵ$)$的去除; $\\rm CaS_{5}+FeSO_{4}=FeS+4S+CaSO_{4}$
"]]①结合第一问可知,$\rm pH$增大时会抑制$\text{Ca}{{\text{S}}_{\text{5}}}$对$\text{Cr}\left( \text{VI} \right)$的还原,但是$\text{FeS}{{\text{O}}_{\text{4}}}$的使用有利于对$\text{Cr}\left( \text{VI} \right)$吸附,试剂联用时是两种作用的相互竞争的一个关系,故$\rm pH$增大,使用$\rm CaS_{5}$会抑制$\rm Cr($Ⅵ$)$的还原,降低总$\rm Cr$去除率;但使用$\rm FeSO_{4}$有利于$\rm Cr($Ⅵ$)$的固定,提高总$\rm Cr$去除率;试剂联用时,$\rm FeSO_{4}$的用量大于$\rm CaS_{5}$,增大$\rm pH$,$\rm FeSO_{4}$对总$\rm Cr$去除率的影响程度大于$\rm CaS_{5}$;
②由图可知,随着碳酸氢根离子的浓度的增大,$\rm pH$会降低,而$\rm pH$的降低有利于$\text{Ca}{{\text{S}}_{5}}$对$\text{Cr}\left( \text{VI} \right)$的去除,故增大$\text{HCO}_{\text{3}}^{-}$浓度,溶液$\rm pH$减小,试剂联用时低$\rm pH$值有利于$\rm Cr($Ⅵ$)$的去除;
③根据题意可知$\text{Ca}{{\text{S}}_{\text{5}}}$和$\text{FeS}{{\text{O}}_{\text{4}}}$反应生成$\rm FeS$,结合元素守恒和得失电子守恒可知离子方程式为:$\text{Ca}{{\text{S}}_{\text{5}}}\text{+FeS}{{\text{O}}_{\text{4}}}\text{=FeS+4S+CaS}{{\text{O}}_{\text{4}}}$;
检测酸性废水中$\text{NO}_{\text{3}}^{-}$含量,取$\rm 20.00\;\rm mL$废水,加水稀释至$\rm 100.00\;\rm mL$。量取$\rm 20.00\;\rm mL$该溶液,加入$\rm 30.00\;\rm mL\;\rm 0.0100\;\rm mol/L$ $\rm FeSO_{4}$标准溶液$\rm ($过量$\rm )$,充分反应后,用$\rm 0.0010\;\rm mol/L$ $\rm K_{2}Cr_{2}O_{7}$标准溶液滴定剩余的$\rm Fe$²$\rm ^{+}$,终点时消耗$\rm K_{2}Cr_{2}O_{7}$溶液$\rm 10.00$ $\rm mL($假设$\text{NO}_{\text{3}}^{-}$的还原产物全为$\rm NO$,且$\rm NO$全部从溶液中逸出$\rm )$。则废水中$\text{NO}_{\text{3}}^{-}$含量为 $\rm \;\rm mol/L$。 $\rm ($写出计算过程$\rm )$
$\\rm 0.02$
"]]根据反应,$\text{C}\text{r}_{\text{2}}\text{O}_{\text{7}}^{^{\text{2-}}} +\text{6F}\text{e}^{\text{2+}}+\text{14}\text{H}^{+}\text{=2C}\text{r}^{\text{3+}}+\text{6F}\text{e}^{\text{3+}}+\text{7}\text{H}_{\text{2}}\text{O}$,与$\rm K_{2}Cr_{2}O_{7}$标准溶液反应的亚铁离子物质的量$\textit{n}\left( \text{F}\text{e}^{\text{2}}\right)=\text{6}\times\text{10}\times\text{1}\text{0}^{\text{-3}}\times\text{0}\text{.001=0}\text{.00006\ mol}$,硝酸根氧化硫酸亚铁的物质的量为$\textit{n}\left( \text{FeS}\text{O}_{\text{4}}\right)\text{=30}\times\text{1}\text{0}^{\text{-3}}\times\text{0}\text{.01\ mol}-\text{0.00006\ mol =0}\text{.00024\ mol}$,根据反应$\text{3F}\text{e}^{\text{2+}}+\text{NO}_{3}^{-}+\text{4}\text{H}^{+}\text{=NO}\uparrow\text{3F}\text{e}^{\text{3+}}+\text{2}\text{H}_{\text{2}}\text{O}$,$\textit{n}\left( \text{NO}_{3}^{-}\right)=\dfrac{1}{3}\times\text{0}\text{.00024\ mol}\times\dfrac{100}{20}\text{=0}\text{.0004\ mol}$,$\textit{c}\left( \text{NO}_{3}^{-}\right)=\dfrac{\textit{n}}{\textit{V}}=\dfrac{\text{0}\text{.0004\ mol}}{20\times10^{-3}\ \text{L}}=0.02\ \text{mol/L}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
