高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
硫代硫酸钠被广泛用于纺织、造纸、化学合成等工业领域。制备硫代硫酸钠的装置如下图所示。
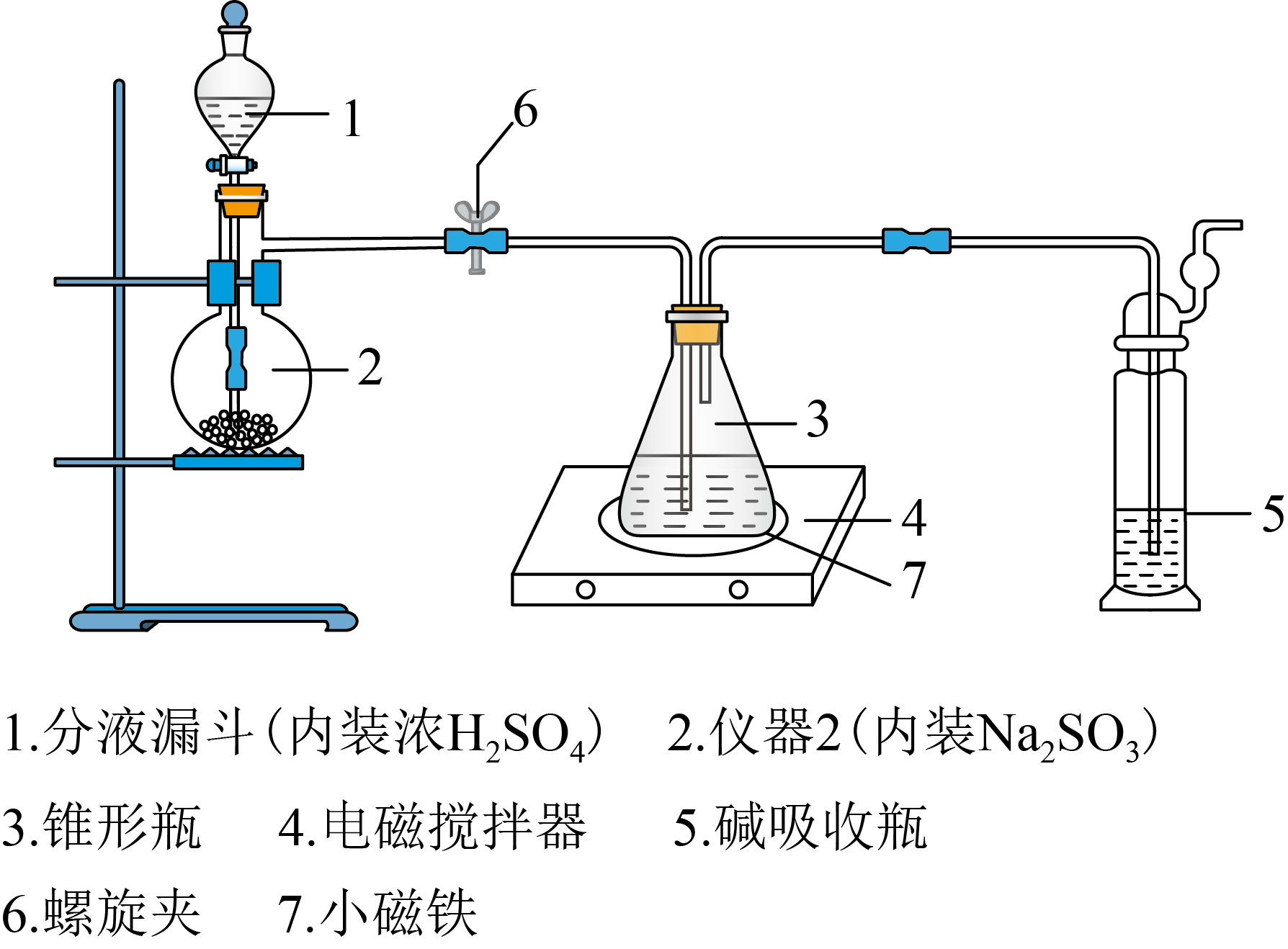
实验步骤如下:
将浓硫酸缓缓注入仪器$\rm 2$中,适当调节螺旋夹$\rm 6$,使反应产生的气体均匀地进入锥形瓶中$\rm ($硫化钠$\rm -$碳酸钠溶液$\rm )$,并采用电磁搅拌器进行搅拌和加热。
持续通入气体,直至溶液的$\rm pH=7($注意不要小于$\rm 7)$,停止通入气体。
将锥形瓶中的液体转移至烧杯中,________,过滤,得到$\mathrm{Na}_{2} \mathrm{S}_{2} \mathrm{O}_{3} \cdot 5 \mathrm{H}_{2} \mathrm{O}$晶体样品。
精确称取$\rm 0.5000$ $\rm g$步骤$\rm 3$的样品,用少量水溶解,再注入$\rm 10$ $\rm mL$醋酸$\rm -$醋酸钠的缓冲溶液。以淀粉为指示剂,用$\rm 0.1000$ $\rm mol/L$的碘标准溶液滴定至终点,消耗标准溶液的体积为$V\text{ mL}$。
已知:$2{{\text{S}}_{2}}\text{O}_{3}^{2-}+{{\text{I}}_{2}}={{\text{S}}_{4}}\text{O}_{6}^{2-}+2{{\text{I}}^{-}}$
请回答下列问题:
仪器$\rm 2$的名称是 。
蒸馏烧瓶
"]]据仪器$\rm 2$的构造可知,其名称是蒸馏烧瓶;
写出生成硫代硫酸钠总反应的化学方程式 。
$\\text{2N}{{\\text{a}}_{\\text{2}}}\\text{S+N}{{\\text{a}}_{\\text{2}}}\\text{C}{{\\text{O}}_{\\text{3}}}\\text{+4S}{{\\text{O}}_{\\text{2}}}\\begin{matrix} \\underline{\\underline{_{\\triangle }}} \\\\ {} \\\\ \\end{matrix}\\text{3N}{{\\text{a}}_{\\text{2}}}{{\\text{S}}_{\\text{2}}}{{\\text{O}}_{\\text{3}}}\\text{+C}{{\\text{O}}_{\\text{2}}}$
"]]二氧化硫与硫化钠和碳酸钠的混合溶液在加热条件下反应生成硫代硫酸钠,其总反应的化学方程式为$\text{2N}{{\text{a}}_{\text{2}}}\text{S+N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}\text{+4S}{{\text{O}}_{\text{2}}}\begin{matrix} \underline{\underline{_{\triangle }}} \\ {} \\ \end{matrix}\text{3N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}\text{+C}{{\text{O}}_{\text{2}}}$;
补齐步骤$\rm 3$的实验操作 。
蒸发浓缩、冷却结晶
"]]步骤$\rm 3$是从混合液中得$\mathrm{Na}_{2} \mathrm{S}_{2} \mathrm{O}_{3} \cdot 5 \mathrm{H}_{2} \mathrm{O}$,其实验操作为蒸发浓缩、冷却结晶,过滤;
用必要的文字说明为什么溶液的$\rm pH$不能小于$\rm 7$ 。
$\\rm Na_{2}S_{2}O_{3}$在酸性条件下不稳定,发生化学反应
"]]$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$中硫元素的平均化合价为$\rm +2$价,其在酸性条件下不稳定,会发生化学反应,所以溶液的$\rm pH$不能小于$\rm 7$;
①滴定时,应使用 $\rm ($填“酸式”或“碱式”$\rm )$滴定管。
②滴定达到终点的标志是 。
③$\mathrm{Na}_{2} \mathrm{S}_{2} \mathrm{O}_{3} \cdot 5 \mathrm{H}_{2} \mathrm{O}$晶体的质量分数为 $\rm ($用含有$V$的代数式表示$\rm )$。
④下列说法错误的是 。
$\rm a.$滴定读数时,应单手持滴定管上端并保持其自然垂直
$\rm b.$滴定实验中用到的玻璃仪器是烧杯、锥形瓶、滴定管
$\rm c.$滴定前滴定管尖嘴处有气泡,导致实验结果偏低
$\rm d.$用标准液润洗滴定管后,应将润洗液从滴定管上口倒出
酸性 ; 当滴入最后半滴标准液,溶液由无色变成蓝色,且半分钟内不褪色 ; $9.92V\\%$ ; $\\rm cd$
"]]①滴定时,由于碘溶液呈弱酸性,且碘会腐蚀橡胶,所以应使用酸式滴定管;
②在$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$被消耗完全之前,碘不会有剩余,溶液呈无色,当两者恰好完全反应之后,再继续滴加半滴标准液,溶液由无色变成蓝色,且半分钟内不褪色,所以滴定达到终点的标志是当滴入最后半滴标准液,溶液由无色变成蓝色,且半分钟内不褪色,说明达到滴定终点;
③精确称取$\rm 0.5000$ $\rm g$步骤$\rm 3$的样品,以淀粉为指示剂,用$\rm 0.1000$ $\rm mol/L$的碘标准溶液滴定至终点,消耗标准溶液的体积为$V\text{ mL}$,反应的离子方程式为$2{{\text{S}}_{2}}\text{O}_{3}^{2-}+{{\text{I}}_{2}}={{\text{S}}_{4}}\text{O}_{6}^{2-}+2{{\text{I}}^{-}}$,即$n(\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}\cdot 5{{\text{H}}_{2}}\text{O})=2n\left( {{\text{I}}_{\text{2}}} \right)$,则$\mathrm{Na}_{2} \mathrm{S}_{2} \mathrm{O}_{3} \cdot 5 \mathrm{H}_{2} \mathrm{O}$晶体的质量分数为$\dfrac{0.1000\text{ mol}/\text{L}\times \left( V\times {{10}^{-3}} \right)\text{ L}\times 2\times 248\text{ g}/\text{mol}}{0.5000\text{ g}}\times 100\%=9.92V\%$;
④$\rm a.$滴定读数时,为使读数准确,应单手持滴定管上端并保持其自然垂直,故$\rm a$正确;
$\rm b.$滴定实验中需要用到的仪器是烧杯、锥形瓶、滴定管、滴定管夹、铁架台,其中的玻璃仪器是烧杯、锥形瓶、滴定管,故$\rm b$正确;
$\rm c.$滴定前滴定管尖嘴处有气泡,会导致一部分标准液占据读数,但没参与反应,即标准液体积偏大,导致实验结果偏高,故$\rm c$错误;
$\rm d.$用标准液润洗滴定管后,应将润洗液从滴定管下口放出,故$\rm d$错误。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
