高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
黏土钒矿中,钒以$\rm +3$、$\rm +4$、$\rm +5$的化合物存在,还包括钾、镁的铝硅酸盐,以及$\text{Si}{{\text{O}}_{2}}\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$。黏土钒矿采用以下工艺流程可制备偏钒酸铵。
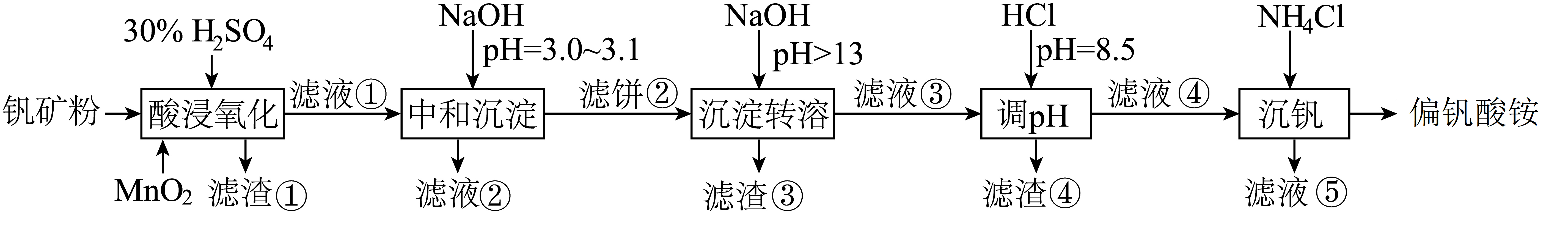
该工艺条件下,溶液中金属离子开始沉淀和完全沉淀的$\text{pH}$如下表所示:
| 金属离子 | $\text{F}{{\text{e}}^{3+}}$ | $\text{F}{{\text{e}}^{2+}}$ | $\text{A}{{\text{l}}^{3+}}$ | $\text{M}{{\text{n}}^{2+}}$ |
| 开始沉淀$\text{pH}$ | $\rm 1.9$ | $\rm 7.0$ | $\rm 3.0$ | $\rm 8.1$ |
| 完全沉淀$\text{pH}$ | $\rm 3.2$ | $\rm 9.0$ | $\rm 4.7$ | $\rm 10.1$ |
回答下列问题:
钒在周期表中的位置为 。
第四周期$\\rm VB$族
"]]钒在周期表中的位置为第四周期$\rm VB$族;
写出“酸浸氧化”中$\text{V}{{\text{O}}^{2+}}$转化为$\text{VO}_{2}^{+}$的离子方程式 。
$\\text{2V}{{\\text{O}}^{2+}}+\\text{Mn}{{\\text{O}}_{\\text{2}}}=2\\text{VO}_{2}^{+}+\\text{M}{{\\text{n}}^{\\text{2+}}}$
"]]“酸浸氧化”中$\text{V}{{\text{O}}^{2+}}$被$\text{Mn}{{\text{O}}_{\text{2}}}$氧化为$\text{VO}_{2}^{+}$,$\text{Mn}{{\text{O}}_{\text{2}}}$被还原为$\text{M}{{\text{n}}^{\text{2+}}}$,反应的离子方程式为$\text{2V}{{\text{O}}^{2+}}+\text{Mn}{{\text{O}}_{\text{2}}}=2\text{VO}_{2}^{+}+\text{M}{{\text{n}}^{\text{2+}}}$;
“中和沉淀”中,钒水解并沉淀为${\rm V_{2}O_{5}}·x{\rm H_{2}O}$,滤液②中金属阳离子有${{\text{K}}^{+}}、\text{M}{{\text{g}}^{2+}}$、$\text{N}{{\text{a}}^{+}}$ 。
$\\text{M}{{\\text{n}}^{\\text{2+}}}$和部分$\\text{F}{{\\text{e}}^{\\text{3+}}}、\\text{A}{{\\text{l}}^{\\text{3+}}}$
"]]“中和沉淀”中,$\rm pH$值为$\rm 3.0-3.1$之间,除了钒水解并沉淀为${\rm V_{2}O_{5}}·x{\rm H_{2}O}$,此过程中$\rm Fe^{3+}$部分转化为$\rm Fe(OH)_{3}$沉淀,部分$\rm Al^{3+}$转化为$\rm Al(OH)_{3}$沉淀,则滤液②中金属阳离子有${{\text{K}}^{+}}、\text{M}{{\text{g}}^{2+}}$、$\text{N}{{\text{a}}^{+}}$还有前面生成的$\text{M}{{\text{n}}^{\text{2+}}}$和部分$\text{F}{{\text{e}}^{\text{3+}}}、\text{A}{{\text{l}}^{\text{3+}}}$;
“沉淀转溶”中,$\mathrm{V}_{2} \mathrm{O}_{5}$溶解为$\text{VO}_{3}^{-}$或$\text{VO}_{4}^{3-}$,滤渣③的主要成分是 。
$\\text{Fe(OH}{{\\text{)}}_{\\text{3}}}$
"]]“沉淀转溶”中,$\rm pH$大于$\rm 13$, $\mathrm{V}_{2} \mathrm{O}_{5}$溶解为$\text{VO}_{3}^{-}$或$\text{VO}_{4}^{3-}$,$\text{Al(OH}{{\text{)}}_{\text{3}}}$会溶解,滤渣$\rm 3$的成分为$\text{Fe(OH}{{\text{)}}_{\text{3}}}$;
“调$\text{pH}$”中有沉淀产生,生成沉淀反应的化学方程式是 。
$\\text{NaAl(OH}{{\\text{)}}_{\\text{4}}}+\\text{HCl}=\\text{Al(OH}{{\\text{)}}_{\\text{3}}}\\downarrow +\\text{NaCl}+{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]“调$\text{pH}$”时有沉淀生成,是$\text{NaAl(OH}{{\text{)}}_{\text{4}}}$与$\text{HCl}$反应生成$\text{Al(OH}{{\text{)}}_{\text{3}}}$沉淀,故生成沉淀反应的化学方程式是$\text{NaAl(OH}{{\text{)}}_{\text{4}}}+\text{HCl}=\text{Al(OH}{{\text{)}}_{\text{3}}}\downarrow +\text{NaCl}+{{\text{H}}_{\text{2}}}\text{O}$;
偏钒酸铵,其阴离子呈如图所示的无限链状结构,则偏钒酸铵的化学式为 。
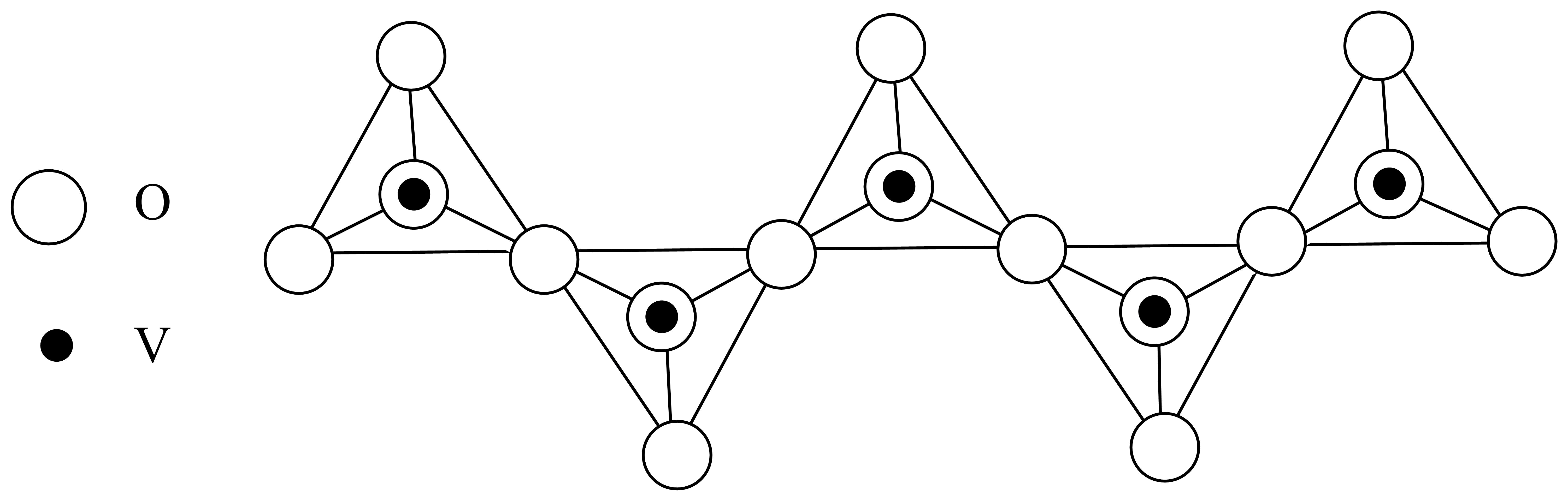
$\\text{N}{{\\text{H}}_{\\text{4}}}\\text{VO}_{\\text{3}}^{{}}$
"]]由链状结构可知每个$\rm V$与$\rm 3$个$\rm O$形成阴离子,且$\rm V$的化合价为$\rm +5$价,则形成的偏钒酸铵的化学式为$\text{N}{{\text{H}}_{\text{4}}}\text{VO}_{3}^{{}}$;
全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示。
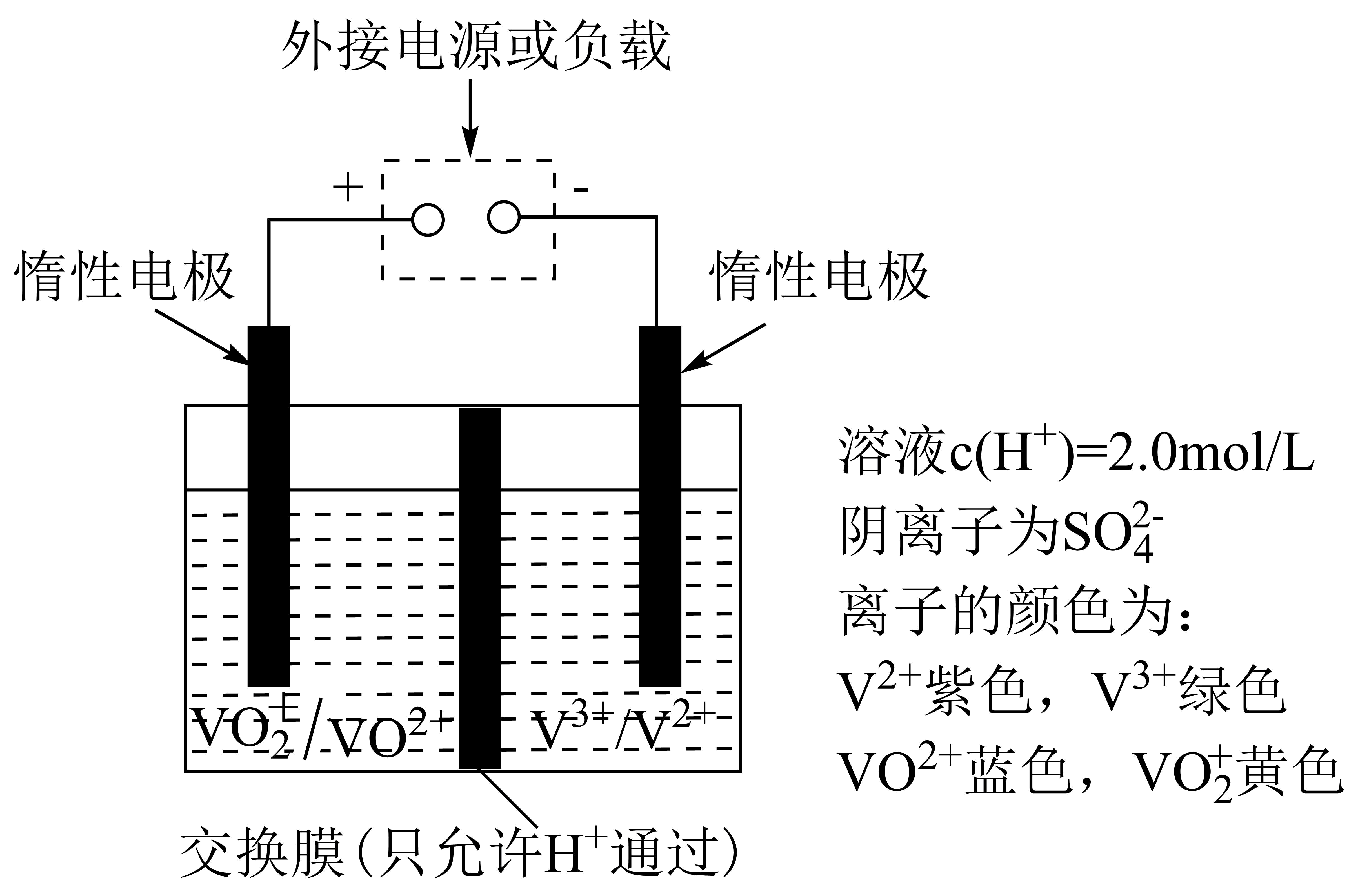
①左槽溶液逐渐由黄变蓝,其电极反应式为 。
②充电时若转移的电子数为$3.01\times {{10}^{23}}$个,左槽溶液中${{\text{H}}^{+}}$物质的量的变化量为 。
$\\text{VO}_{\\text{2}}^{+}+{{\\text{e}}^{-}}+\\text{2}{{\\text{H}}^{+}}=\\text{V}{{\\text{O}}^{\\text{2+}}}+{{\\text{H}}_{\\text{2}}}\\text{O};\\text{0}{.5\\;\\rm mol}$
"]]①根据题干信息,左槽溶液逐渐由黄变蓝,说明是由$\text{VO}_{2}^{+}$变为$\text{V}{{\text{O}}^{2+}}$,因此电极反应式为$\text{VO}_{\text{2}}^{+}+{{\text{e}}^{-}}+\text{2}{{\text{H}}^{+}}=\text{V}{{\text{O}}^{\text{2+}}}+{{\text{H}}_{\text{2}}}\text{O}$,说明此时为原电池,且为原电池的正极;
②充电时左槽发生的反应$\text{V}{{\text{O}}^{\text{2+}}}+{{\text{H}}_{\text{2}}}\text{O}-{{\text{e}}^{-}}=\text{VO}_{2}^{+}+\text{2}{{\text{H}}^{+}}$,当转移的电子数为$3.01\times {{10}^{23}}$个即$\text{0}{.5\;\rm mol}$,生成${{\text{H}}^{+}}$为$\text{1\;\rm mol}$,同时有$\rm 0.5\;\rm mol$ $\rm H^{+}$从左槽通过交换膜到达右槽,则左槽中${{\text{H}}^{+}}$变化为$\text{0}{.5\;\rm mol}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
