高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
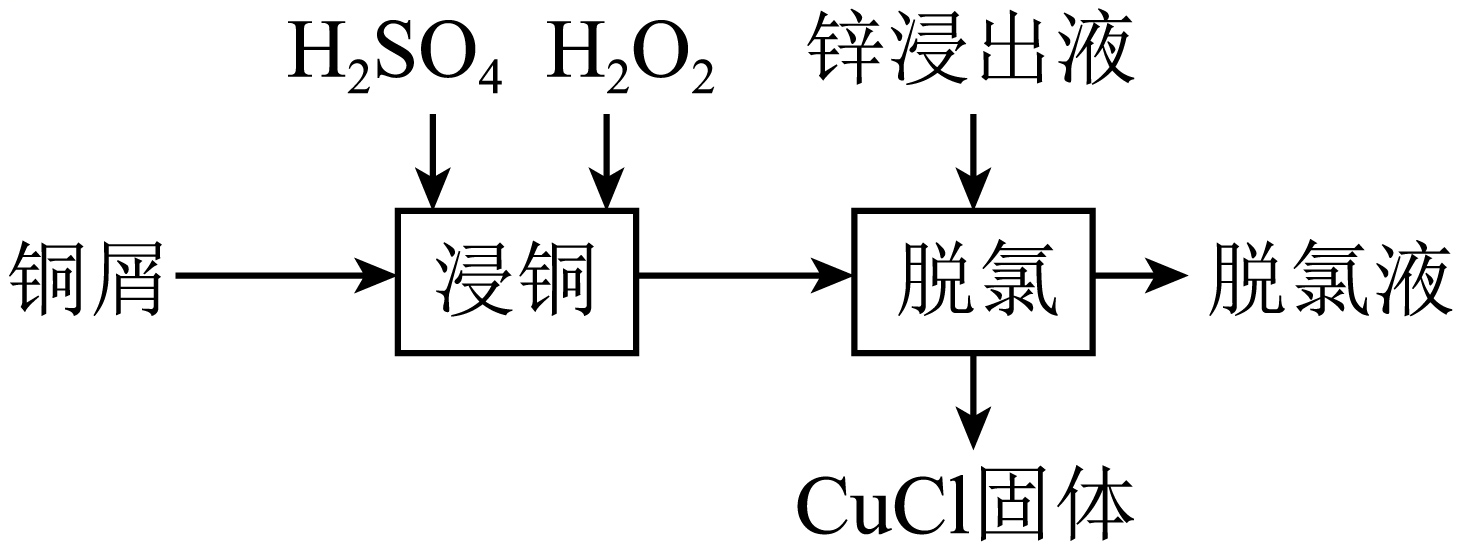
某工厂利用铜屑脱除锌浸出液中的$\rm C{{l}^{-}}$并制备$\rm Zn$,流程如下“脱氯”步骤仅$\rm Cu$元素化合价发生改变。下列说法正确的是$\rm (\qquad)$
锌浸出液中相关成分$\rm ($其他成分无干扰$\rm )$
| 离子 | $\rm Z{{n}^{2+}}$ | $\rm C{{u}^{2+}}$ | $\rm C{{l}^{-}}$ |
| 浓度$\rm (g\cdot {{L}^{-1}})$ | $\rm 145$ | $\rm 0.03$ | $\rm 1$ |
“浸铜”时应加入足量$\\rm {{H}_{2}}{{O}_{2}}$,确保铜屑溶解完全
","“浸铜”反应:$\\rm 2Cu+4{{H}^{+}}+{{H}_{2}}{{O}_{2}}=2C{{u}^{2+}}+{{H}_{2}}\\uparrow +2{{H}_{2}}O$
","“脱氯”反应:$\\rm Cu+C{{u}^{2+}}+2C{{l}^{-}}=2CuCl$
","脱氯液净化后电解,可在阳极得到$\\rm Zn$
"]铜屑中加入$\rm H_{2}SO_{4}$和$\rm H_{2}O_{2}$得到$\rm Cu^{2+}$,反应的离子方程式为:$\rm Cu+2{{H}^{+}}+{{H}_{2}}{{O}_{2}}=C{{u}^{2+}}+2{{H}_{2}}O$,再加入锌浸出液进行“脱氯”,“脱氯”步骤中仅$\rm Cu$元素的化合价发生改变,得到$\rm CuCl$固体,可知“脱氯”步骤发生反应的化学方程式为:$\rm C{{u}^{2+}}+Cu+2C{{l}^{-}}=2CuCl\downarrow $,过滤得到脱氯液,脱氯液净化后电解,$\rm Zn^{2+}$可在阴极得到电子生成$\rm Zn$。
$\rm A$.由分析得,“浸铜”时,铜屑不能溶解完全,$\rm Cu$在“脱氯”步骤还需要充当还原剂,故$\rm A$错误;
$\rm B$.“浸铜”时,铜屑中加入$\rm H_{2}SO_{4}$和$\rm H_{2}O_{2}$得到$\rm Cu^{2+}$,反应的离子方程式为:$\rm Cu+2{{H}^{+}}+{{H}_{2}}{{O}_{2}}=C{{u}^{2+}}+2{{H}_{2}}O$,故$\rm B$错误;
$\rm C$.“脱氯”步骤中仅$\rm Cu$元素的化合价发生改变,得到$\rm CuCl$固体,即$\rm Cu$的化合价升高,$\rm Cu^{2+}$的化合价降低,发生归中反应,化学方程式为:$\rm C{{u}^{2+}}+Cu+2C{{l}^{-}}=2CuCl\downarrow $,故$\rm C$正确;
$\rm D$.脱氯液净化后电解,$\rm Zn^{2+}$应在阴极得到电子变为$\rm Zn$,故$\rm D$错误;
故选:$\rm C$
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
