高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
磷化铝$\rm (AlP)$通常可作为一种广谱性熏蒸杀虫剂,粮食仓储常用磷化铝熏蒸杀虫,某化学兴趣小组的同学用下述方法测定粮食中残留磷化铝的含量。$\rm C$中加入$\rm 100\ g$原粮,$\rm E$中加入$\rm 20.00\ mL\ 1.50\times 10^{-3}\ mol/L$的$\rm KMnO_{4}$溶液$\rm (H_{2}SO_{4}$酸化$\rm )$。往$\rm C$中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定$\rm E$中过量的$\rm KMnO_{4}$溶液。
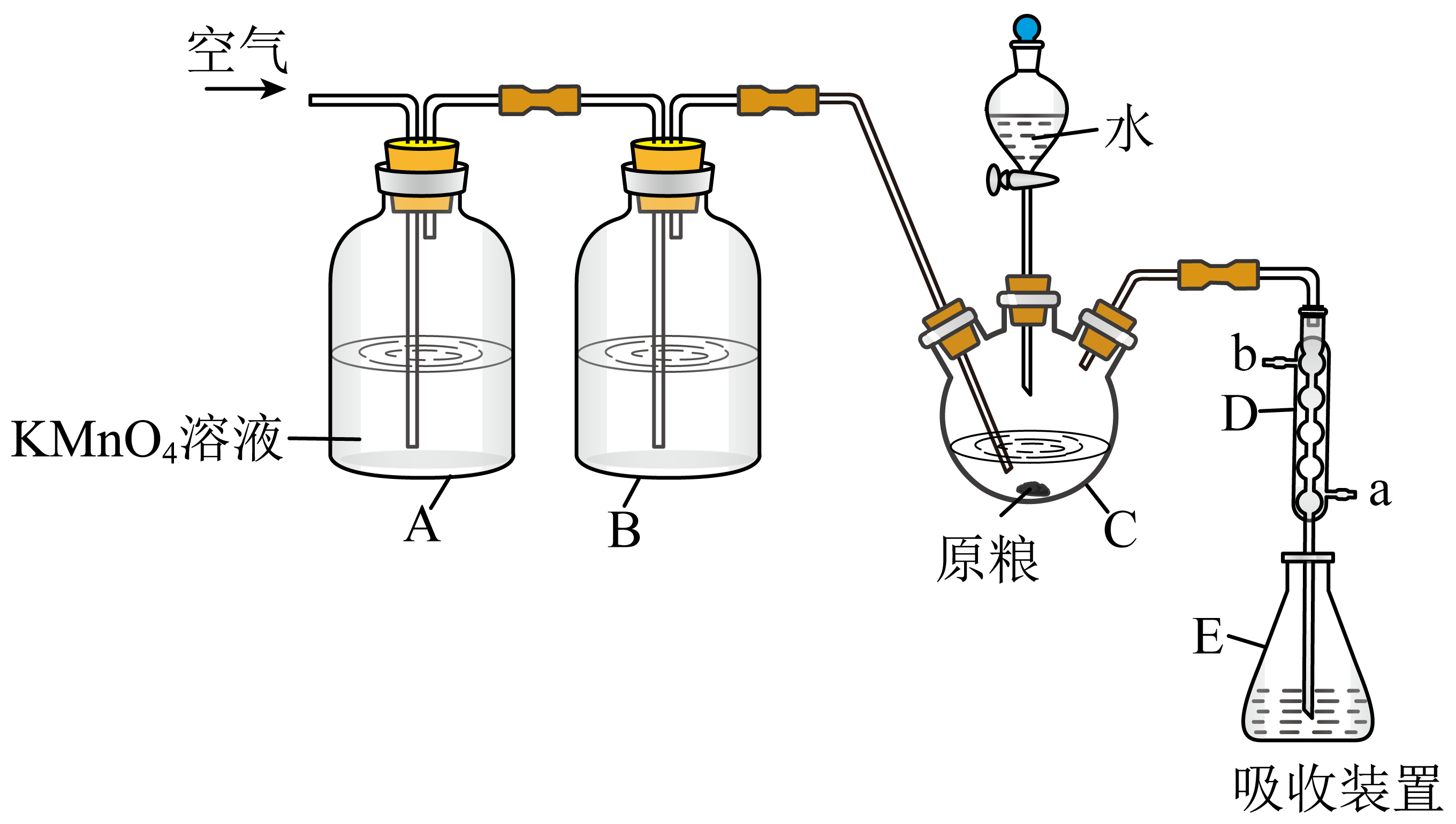
已知:①$\rm AlP$吸水后会立即产生高毒性$\rm pH_{3}$气体$\rm ($沸点$\rm -89.7\ ^\circ \text{C}$,还原性强$\rm )$;
②焦性没食子酸的碱性溶液具有还原性。
回答下列问题:
装置$\rm A$中盛装$\rm KMnO_{4}$溶液的作用是除去空气中的还原性气体。装置$\rm B$中盛有焦性没食子酸的碱性溶液,其作用是 。
吸收空气中的$\\rm O_{2}$
"]]装置$\rm A$中盛装$\rm KMnO_{4}$溶液的作用是除去空气中的还原性气体。装置$\rm B$中盛有焦性没食子酸的碱性溶液,其作用是吸收空气中的$\rm O_{2}$;
装置$\rm C$中反应的化学方程式为 。
$\\rm AlP+3H_{2}O=Al(OH)_{3}+PH_{3}↑$
"]]装置$\rm C$中$\rm H_{2}O$与$\rm AlP$发生反应产生$\rm Al(OH)_{3}$、$\rm PH_{3}$,该反应的化学方程式为:$\rm 3H_{2}O+AlP=Al(OH)_{3}+PH_{3}↑$;
$\rm C$中反应完全后继续通入空气的作用是 。
保证生成的$\\rm PH_{3}$全部被酸性$\\rm KMnO_{4}$溶液吸收
"]]$\rm C$中反应完全后继续通入空气的作用是保证装置$\rm C$生成的$\rm PH_{3}$全部被酸性$\rm KMnO_{4}$溶液吸收;
装置$\rm E$中$\rm PH_{3}$被氧化成磷酸,则$\rm E$中发生反应的离子方程式为 。
$\\rm 5PH_{3}+24H^{+}+8MnO_{4}^{-}=5H_{3}PO_{4}+8Mn^{2+}+12H_{2}O$
"]]在装置$\rm E$中$\rm PH_{3}$被酸性$\rm KMnO_{4}$溶液氧化成磷酸,$\rm KMnO_{4}$被还原产生$\rm MnSO_{4}$,则$\rm E$中发生反应的离子方程式为:$\rm 5PH_{3}+24H^{+}+8MnO_{4}^{-}=5H_{3}PO_{4}+8Mn^{2+}+12H_{2}O$;
收集装置$\rm E$中吸收液,加水稀释至$\rm 250\ mL$,取$\rm 25.00\ mL$于锥形瓶中,用$\rm 4.0\times 10^{-4}\ mol/L$的$\rm Na_{2}SO_{3}$标准溶液滴定剩余的$\rm KMnO_{4}$溶液,滴定终点时消耗$\rm Na_{2}SO_{3}$溶液的体积为$\rm 15.00\ mL$。
①该原粮中磷化铝的含量为 $\rm mg/kg$。
②若滴定过程中不慎将锥形瓶中部分液体外溅,则会导致测定出粮食中磷化铝的残留量 $\rm ($填“偏高”或“偏低”$\rm )$。
$\\rm 2.175$;偏高
"]]①原装置$\rm E$中含有$\rm KMnO_{4}$溶液的物质的量$n{\rm (KMnO_{4})}=1.50\times 10^{-3}\rm \ mol/L\times 0.02\ L=3.0\times 10^{-5}\ mol$。反应后的溶液加水稀释至$\rm 250\ mL$,取$\rm 25.00\ mL$反应后的稀释液用$\rm 4.0\times 10^{-4}\ mol/L$的$\rm Na_{2}SO_{3}$标准溶液滴定剩余的$\rm KMnO_{4}$溶液,滴定终点时消耗$\rm Na_{2}SO_{3}$溶液的体积为$\rm 15.00\ mL$,消耗的$\rm Na_{2}SO_{3}$的物质的量$n{\rm (Na_{2}SO_{3})}=4.0\times 10^{-4}\rm \ mol/L\times 0.015\ L=6.0\times 10^{-6}\ mol$。根据电子守恒可知:$5n{\rm (KMnO_{4})}=2n{\rm (Na_{2}SO_{3})}_{总}+8n{\rm (PH_{3})}$,${\rm 5\times 3.0\times 10^{-5}\ mol=2\times 6.0\times 10^{-6}\ mol\times \dfrac{250\ mL}{25.00\ mL}}+8n{\rm (PH_{3})}$,解得$n{\rm (PH_{3})}=\dfrac{3}{8}\times 10^{-5}\rm \ mol$,根据$\rm P$元素守恒,可知在$\rm 100\ g$原粮中含有$\rm AlP$的物质的量是$n{\rm (AlP)}=n{\rm (PH_{3})}=\dfrac{3}{8}\times 10^{-5}\rm \ mol$,其质量为$m\rm (AlP)=\dfrac{3}{8}\times 10^{-5}\ mol\times 58\ g/mol=2.175\times 10^{-4}\ g$,故该原粮中磷化铝的含量为:$\rm \dfrac{2.175\times {{10}^{-4}}\ g\times 1000\ mg/g}{0.1\ kg}=2.175\ mg/kg$;
②若滴定过程中不慎将锥形瓶中部分液体外溅,则反应消耗$\rm Na_{2}SO_{3}$溶液体积偏少,误认为$\rm AlP$反应产生的$\rm PH_{3}$消耗$\rm KMnO_{4}$就会偏多,因此会导致测定出粮食中磷化铝的残留量偏高;
已知$\rm AlP$的熔点为$\rm 2000\ ^\circ \text{C}$,其晶胞结构如图所示。
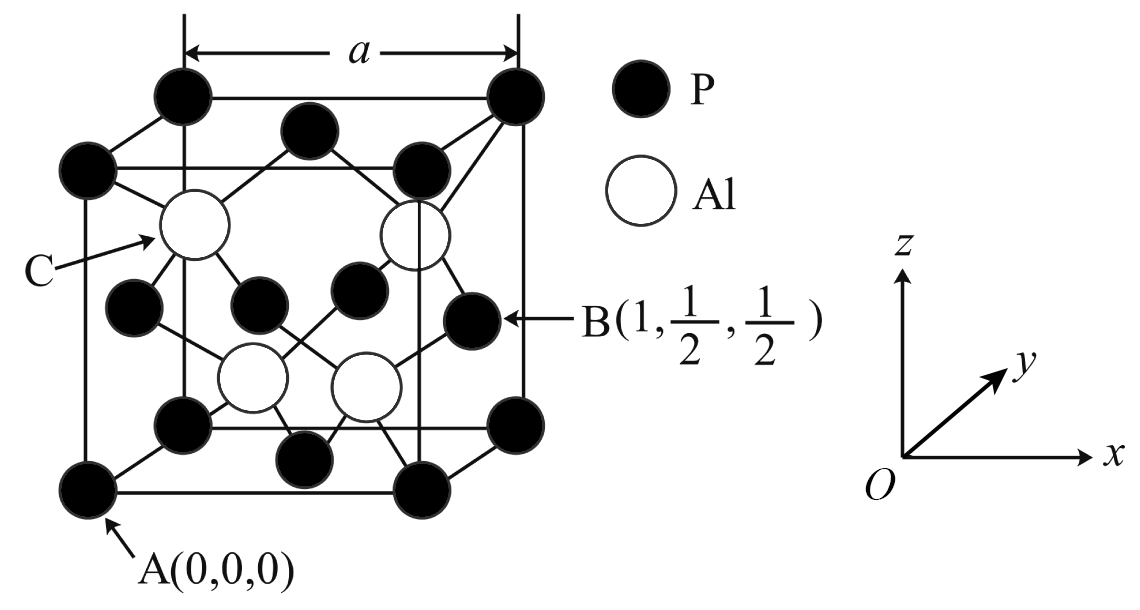
①$\rm A$、$\rm B$点的原子坐标如图所示,则$\rm C$点的原子坐标为 。
②$\rm AlP$晶体中配位键与普通共价键数目之比为 。
$\\rm (\\dfrac{1}{4}$,$\\rm \\dfrac{1}{4}$,$\\rm \\dfrac{3}{4})$;$\\rm 1:3$
"]]①$\rm A$、$\rm B$点的原子坐标如图所示,则根据各个点的相对位置,可知$\rm C$点的原子坐标为$\rm (\dfrac{1}{4}$,$\rm \dfrac{1}{4}$,$\rm \dfrac{3}{4})$;
②$\rm AlP$的熔点很高,说明其晶体类型为共价晶体。$\rm Al$原子价电子数为$\rm 3$,且杂化类型为$\rm sp^{3}$杂化,形成$\rm 4$个$\rm Al-P$共价键。其中有$\rm 3$条杂化轨道与$\rm 3$个$\rm P$原子形成$\rm 3$条共价键,另外一条杂化轨道上无电子,为空轨道,与$\rm P$原子形成配位键,故$\rm AlP$晶体中配位键与普通共价键的数目之比为$\rm 1:3$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
