高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
$\text{Mn}{{\text{O}}_{2}}$可用于制取$\text{C}{{\text{l}}_{2}}$和${{\text{O}}_{2}}$。
实验室制取纯净干燥的$\text{C}{{\text{l}}_{2}}$并检验氯气性质的装置如下图。
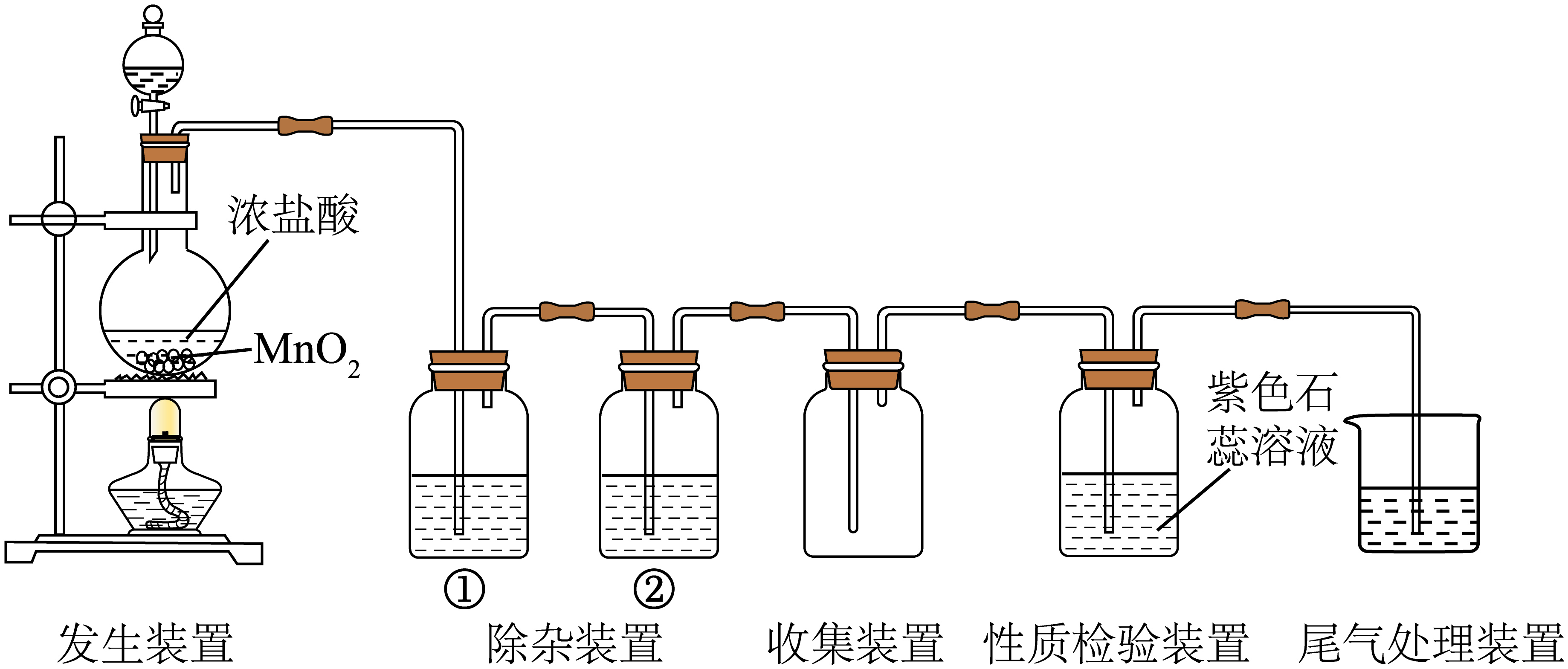
①实验室制取$\text{C}{{\text{l}}_{2}}$的化学方程式是 。
②除杂装置①中的试剂是 。
③性质检验装置中,紫色石蕊试液先变红后褪色。结合离子方程式解释现象变化的原因: 。
$\\text{Mn}{{\\text{O}}_{\\text{2}}}\\text{+4HCl}\\left( 浓\\right)\\begin{array}{*{20}{c}}{\\underline{\\underline {\\triangle}} }\\\\{}\\end{array}\\text{MnC}{{\\text{l}}_{\\text{2}}}\\text{+C}{{\\text{l}}_{\\text{2}}}\\uparrow \\text{+2}{{\\text{H}}_{\\text{2}}}\\text{O}$;饱和食盐水;氯气和水反应生成盐酸和次氯酸,$\\text{C}{{\\text{l}}_{\\text{2}}}+{{\\text{H}}_{\\text{2}}}\\text{O}\\rightleftharpoons {{\\text{H}}^{+}}\\text{+C}{{\\text{l}}^{-}}\\text{+HClO}$,次氯酸具有漂白性
"]]①实验室中二氧化锰和浓盐酸加热生成氯化锰、氯气、水,制取$\text{C}{{\text{l}}_{2}}$的化学方程式是$\text{Mn}{{\text{O}}_{\text{2}}}\text{+4HCl}\left(浓 \right)\begin{array}{*{20}{c}}{\underline{\underline {\triangle}} }\\{}\end{array}\text{MnC}{{\text{l}}_{\text{2}}}\text{+C}{{\text{l}}_{\text{2}}}\uparrow \text{+2}{{\text{H}}_{\text{2}}}\text{O}$ 。
②装置①除氯气中的氯化氢,盛放的试剂是饱和食盐水。
③氯气和水反应生成盐酸和次氯酸,$\text{C}{{\text{l}}_{\text{2}}}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons {{\text{H}}^{+}}\text{+C}{{\text{l}}^{-}}\text{+HClO}$,次氯酸具有漂白性,所以紫色石蕊试液先变红后褪色。
实验室加热$\text{Mn}{{\text{O}}_{2}}$和$\text{KCl}{{\text{O}}_{3}}$的固体混合物制取${{\text{O}}_{2}}$,同时生成$\text{KCl}$,反应中$\text{Mn}{{\text{O}}_{2}}$是催化剂,化学方程式是 。
$\\text{2KCl}{{\\text{O}}_{\\text{3}}}\\begin{matrix} \\underline{\\underline{\\rm Mn{{O}_{2}}}} \\\\\\triangle \\\\ \\end{matrix}\\text{2KCl+3}{{\\text{O}}_{\\text{2}}}\\uparrow $
"]]实验室加热$\text{Mn}{{\text{O}}_{2}}$和$\text{KCl}{{\text{O}}_{3}}$的固体混合物制取${{\text{O}}_{2}}$,同时生成$\text{KCl}$,反应中$\text{Mn}{{\text{O}}_{2}}$是催化剂,可知$\text{KCl}{{\text{O}}_{3}}$分解生成$\rm KCl$和$\rm O_{2}$,化学方程式是$\text{2KCl}{{\text{O}}_{\text{3}}}\begin{matrix} \underline{\underline{\rm Mn{{O}_{2}}}} \\ \triangle\\ \end{matrix}\text{2KCl+3}{{\text{O}}_{\text{2}}}\uparrow $。
在($2$)中得到的${{\text{O}}_{2}}$有刺激性气味,推测反应生成了$\text{C}{{\text{l}}_{2}}$,反应的化学方程式:$2\text{KCl}{{\text{O}}_{3}}+2\text{Mn}{{\text{O}}_{2}}\begin{array}{*{20}{c}}{\underline{\underline {\triangle}} }\\{}\end{array}{{\text{K}}_{2}}\text{M}{{\text{n}}_{2}}{{\text{O}}_{8}}+\text{C}{{\text{l}}_{2}}\uparrow +{{\text{O}}_{2}}\uparrow $。每生成$1\ \text{mol}{{\text{ O}}_{2}}$,该反应共转移电子 $\;\rm \text{mol}$。
$\\rm 10$
"]]反应$2\text{KCl}{{\text{O}}_{3}}+2\text{Mn}{{\text{O}}_{2}}\begin{array}{*{20}{c}}{\underline{\underline {\triangle}} }\\{}\end{array}{{\text{K}}_{2}}\text{M}{{\text{n}}_{2}}{{\text{O}}_{8}}+\text{C}{{\text{l}}_{2}}\uparrow +{{\text{O}}_{2}}\uparrow $中,$\rm Cl$元素化合价由$\rm +5$降低为$\rm 0$,每生成$1\ \text{mol}{{\text{ O}}_{2}}$同时生成$\rm 1\;\rm mol$氯气,该反应共转移电子$\rm 10\text{ mol}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
