高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
工业上利用生产磷肥的副产品高磷镍铁制备硫酸镍晶体$\rm NiSO_{4}·6H_{2}O$。
制备含$\rm Ni^{2+}$溶液
高磷镍铁$\xrightarrow{\text{转炉吹炼}}$镍铁合金$\xrightarrow{\text{电解造液}}$含$\rm Ni^{2+}$溶液
已知:$\rm i.$高磷镍铁和镍铁合金中元素的百分含量:
| 元素$\rm /\%$ | $\rm Ni/\%$ | $\rm Fe/\%$ | $\rm P/\%$ | $\rm Co/\%$ | $\rm Cu/\%$ |
| 高磷镍铁 | $\rm 4.58$ | $\rm 70.40$ | $\rm 16.12$ | $\rm 0.22$ | $\rm 0.34$ |
| 镍铁合金 | $\rm 52.49$ | $\rm 38.30$ | $\rm 5.58$ | $\rm 1.73$ | $\rm 1.52$ |
$\rm ii.$金属活动性:$\rm Fe\gt Co\gt Ni\gt H$
①依据数据,“转炉吹炼”的主要目的是:富集镍元素,除去部分 。
②“电解造液”时,用镍铁合金作阳极,$\rm H_{2}SO_{4}$溶液作电解质溶液。电解过程中阴极产生的气体是 。电解一段时间后,有少量$\rm Ni$在阴极析出,为防止$\rm Ni$析出降低$\rm NiSO_{4}·6H_{2}O$的产率,可向电解质溶液中加入 $\rm ($填试剂$\rm )$。
铁元素和磷元素 ;$\\rm H_{2}$; $\\rm CuSO_{4}$溶液
"]]①由题给数据可知“转炉吹炼”的主要目的是富集镍元素,除去部分铁元素和磷元素,故答案为:铁元素和磷元素;
②“电解造液”时,溶液中的氢离子在阴极得到电子发生还原反应生成氢气;铜离子的氧化性强于镍离子,则电解时应在电解质溶液加入硫酸铜溶液防止镍离子在阴极被还原生成镍,故答案为:$\rm H_{2}$;$\rm CuSO_{4}$溶液;
制备$\rm NiSO_{4}·6H_{2}O$
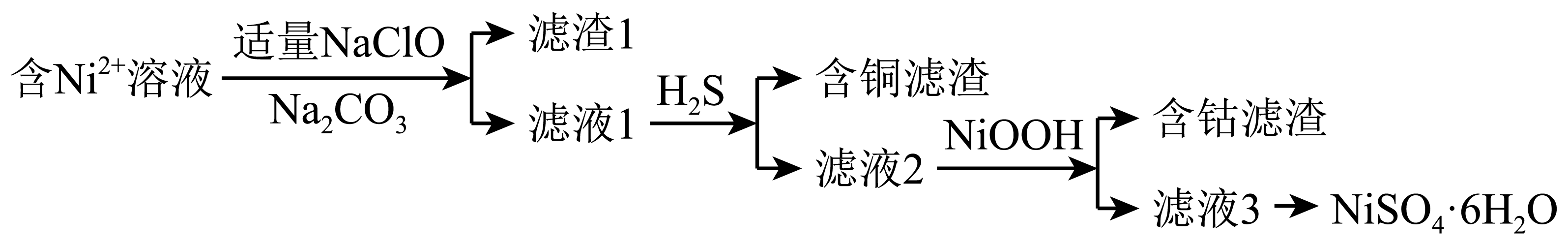
已知:常温下,金属离子完全转化为氢氧化物沉淀的$\rm pH$:
| 金属离子 | $\rm Fe^{3+}$ | $\rm Fe^{2+}$ | $\rm Cu^{2+}$ | $\rm Co^{2+}$ | $\rm Ni^{2+}$ |
| 完全沉淀的$\rm pH$ | $\rm 2.8$ | $\rm 8.3$ | $\rm 6.7$ | $\rm 9.4$ | $\rm 8.9$ |
①在酸性条件下,$\rm NaClO$和$\rm Fe^{2+}$反应生成$\rm Fe^{3+}$和$\rm Cl^{-}$的离子方程式是 。
②已知$\rm Ni(OH)_{2}$的$ K_{\rm sp}$为$\rm 5.48\times 10^{-16}$,滤液$\rm 1$中$ c(\rm Ni^{2+})=1.37\;\rm mol/L$。结合数据说明不能通过调节溶液的$\rm pH$除去$\rm Cu^{2+}$的原因: 。$\rm ($已知:$\rm lg5=0.7)$
③从滤液$\rm 3$中获取$\rm NiSO_{4}·6H_{2}O$的操作是 、洗涤、干燥。
$\\rm ClO^{-}+2Fe^{2+}+2H^{+}=2Fe^{3+}+Cl^{-}+H_{2}O$ ;由$ c(\\rm Ni^{2+})=1.37\\;\\rm mol/L$可知,溶液中$ c(\\rm OH^{-})=$ $\\sqrt{\\dfrac{\\text{5}\\text{.48}\\times \\text{1}{{\\text{0}}^{\\text{-16}}}}{\\text{1}\\text{.37\\;\\rm mol/L}}}\\rm =2\\times 10^{-8}\\;\\rm mol/L$,溶液$\\rm pH=6.3$,小于铜离子完全沉淀的$\\rm pH=6.7$ ;加热浓缩、冷却结晶、过滤
"]]①由题意可知,在酸性条件下,次氯酸根离子和亚铁离子反应生成铁离子、氯离子和水,反应的离子方程式为$\rm ClO^{-}+2Fe^{2+}+2H^{+}=2Fe^{3+}+Cl^{-}+H_{2}O$;
②由氢氧化镍的溶度积可知,滤液$\rm 1$中$ c(\rm Ni^{2+})=1.37\;\rm mol/L$时,溶液中$ c(\rm OH^{-})=$ $\sqrt{\dfrac{\text{5}\text{.48}\times \text{1}{{{0}}^{{-16}}}}{\text{1}{.37\;\rm mol/L}}}\rm =2\times 10^{-8}\;\rm mol/L$,溶液的$\rm pH=14-7-lg5=6.3\lt 6.7$,则溶液中的铜离子不能完全除去;
③由分析可知,从滤液$\rm 3$中获取六水硫酸镍晶体的操作为加热浓缩、冷却结晶、过滤、洗涤、干燥。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
