高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
碳、硫的含量影响钢铁性能,碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定。
采用装置$\rm A$,在高温下$x$克钢样中碳、硫转化为$\rm CO_{2}$、$\rm SO_{2}$。
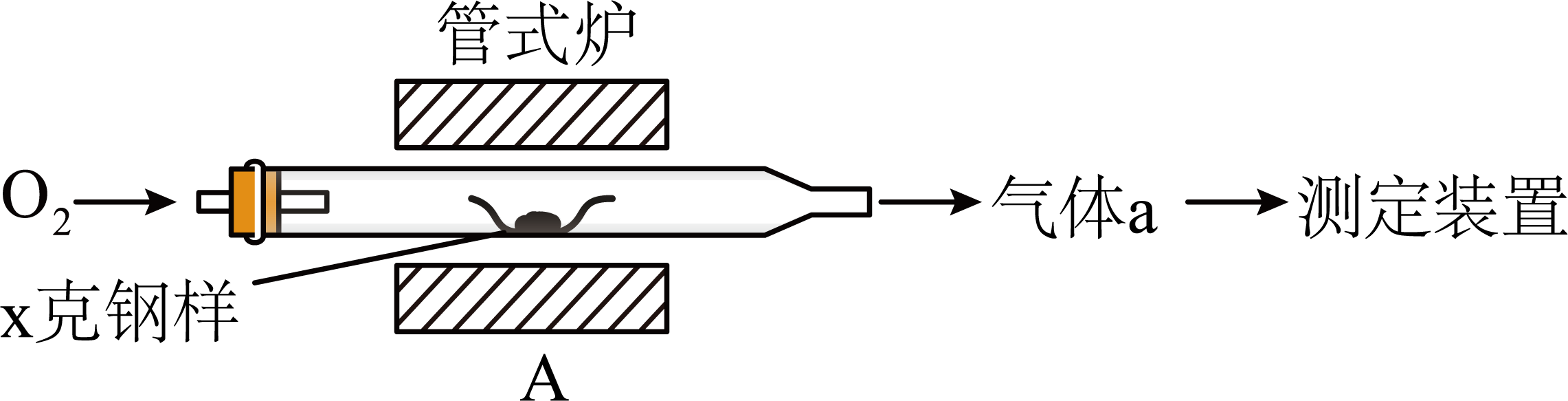
①气体$\rm a$的成分是 。
②若钢样中硫以$\rm FeS$形式存在,$\rm A$中反应:$\rm 3FeS+5 O_{2}\begin{array}{*{20}{c}}{\underline{\underline {高温}} }\\{}\end{array} 1$ $\rm +3$ 。
$\\rm CO_{2}$、$\\rm SO_{2}$、$\\rm O_{2}$;$\\rm Fe_{3}O_{4}$;$\\rm SO_{2}$
"]]①钢样中的碳、硫在装置$\rm A$中被氧化为$\rm CO_{2}$、$\rm SO_{2}$,故$a$的成分为$\rm CO_{2}$、$\rm SO_{2}$以及未反应的$\rm O_{2}$;
②$\rm FeS$中的$\rm -2$价的硫被氧化为$\rm SO_{2}$,$\rm +2$价的$\rm Fe$被氧化为$\rm +3$价的铁,结合所给化学计量数,可知产物应为$\rm Fe_{3}O_{4}$和$\rm SO_{2}$,故方程式为$\rm 3FeS+5O_{2}\begin{array}{*{20}{c}}{\underline{\underline {高温}} }\\{}\end{array} Fe_{3}O_{4}+3SO_{2}$;
将气体$\rm a$通入测硫酸装置中(如右图),采用滴定法测定硫的含量。
①$\rm H_{2}O_{2}$氧化$\rm SO_{2}$的化学方程式: 。
②用$\rm NaOH$溶液滴定生成的$\rm H_{2}SO_{4}$,消耗$z\;\rm mL\;NaOH$溶液,若消耗$\rm 1\;\rm mL\;\rm NaOH$溶液相当于硫的质量为$y$克,则该钢样中硫的质量分数: 。
$\\rm H_{2}O_{2}+SO_{2}=H_{2}SO_{4}$;$ zy/x$
"]]①$\rm H_{2}O_{2}$具有氧化性,可氧化$\rm SO_{2}$使$\rm S$的化合价升高为$\rm +6$价,在溶液中反应产物应为硫酸,故反应方程式为:$\rm H_{2}O_{2}+SO_{2}=H_{2}SO_{4}$;
②$\rm 1\;\rm mL\; NaOH$相当于$ y\;\rm g\;\rm S$,故$z\;\rm mL\; NaOH$相当于$ zy\;\rm g\;\rm S$,则该样品中硫的质量分数为$ zy/x$ 。
将气体$\rm a$通入测碳装置中(如下图),采用重量法测定碳的含量。
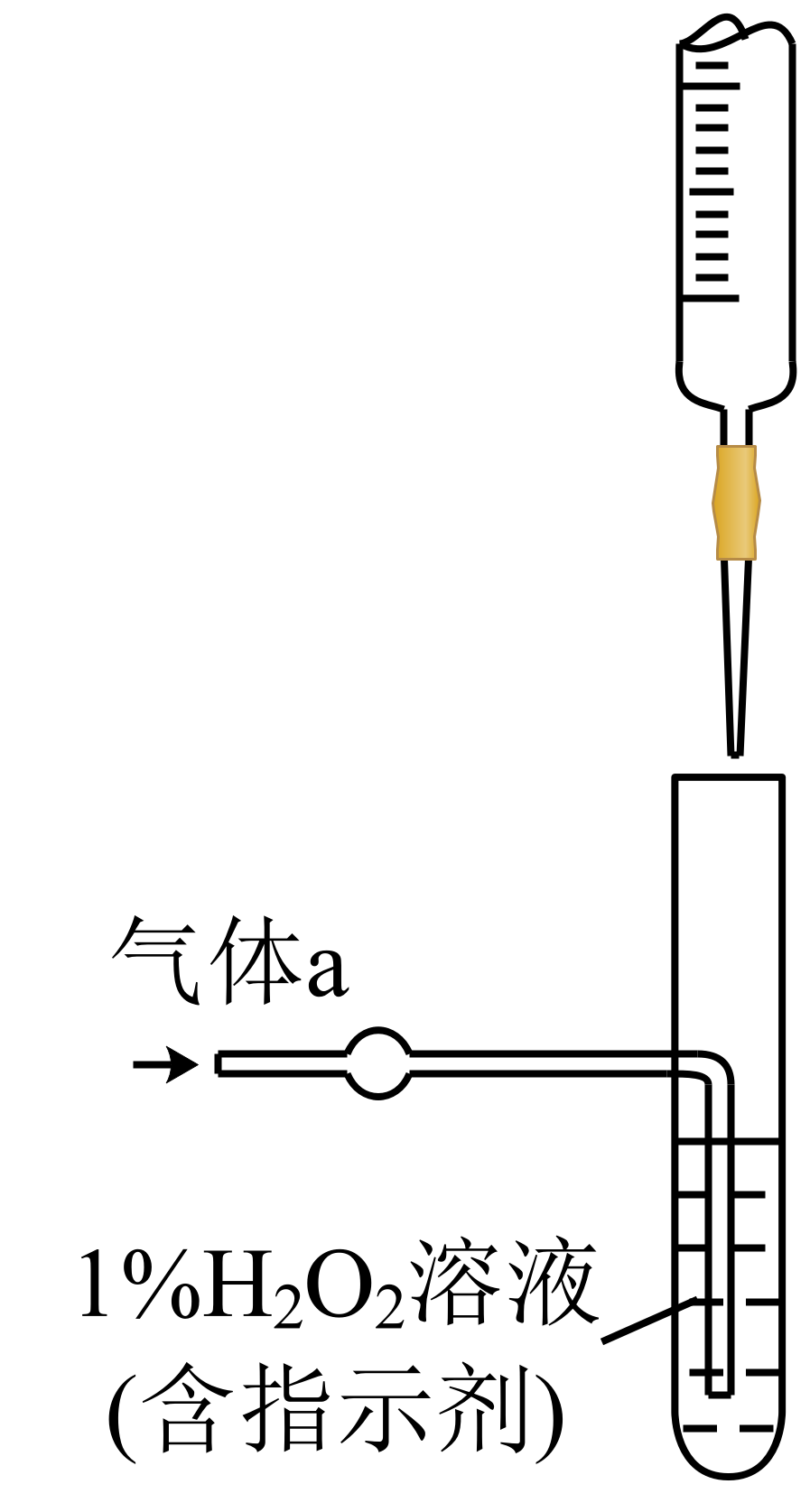
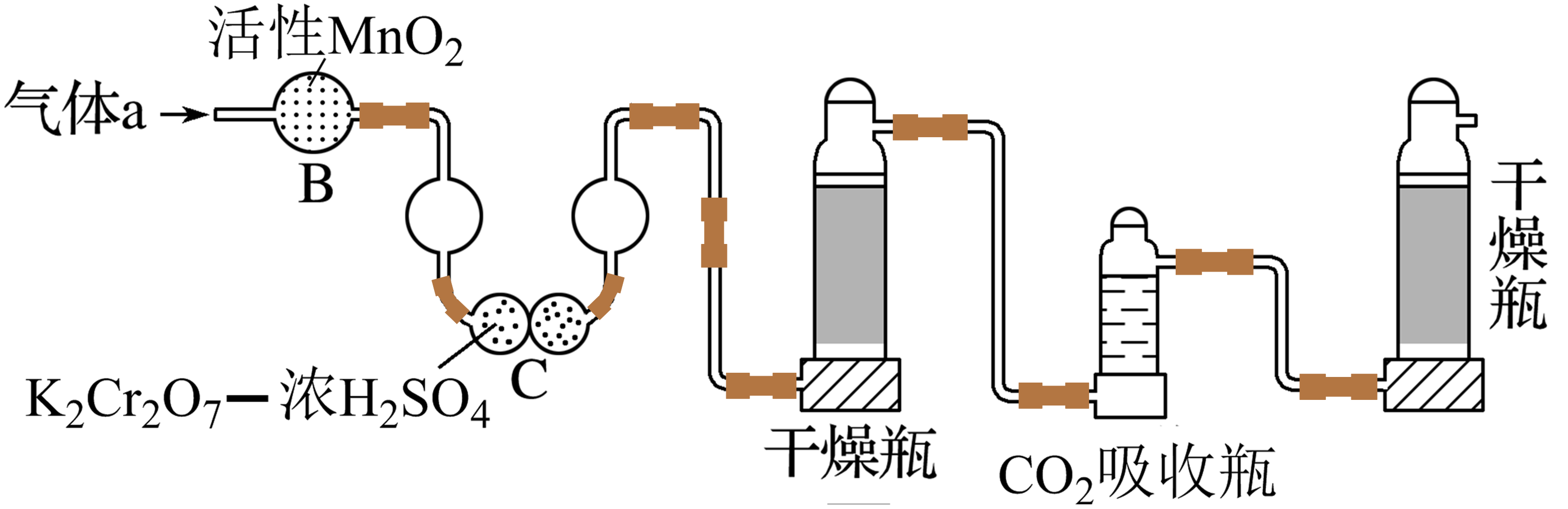
①气体$\rm a$通过$\rm B$和$\rm C$的目的是 。
②计算钢样中碳的质量分数,应测量的数据是 。
除去$\\rm SO_{2}$对$\\rm CO_{2}$测定的干扰;吸收$\\rm CO_{2}$气体前后吸收瓶的质量
"]]①测定碳的含量需将气体$\rm a$中的$\rm SO_{2}$除去,故装置$\rm B$和$\rm C$的作用是除去$\rm SO_{2}$;
②计算碳的质量分数须利用$\rm CO_{2}$的质量进行分析,故需测量$\rm CO_{2}$吸收瓶在吸收$\rm CO_{2}$气体前后的质量。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
