高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
$\rm SCR$和$\rm NSR$技术可有效降低柴油发动机在空气过量条件下的$\rm NO_{x}$排放。
$\rm SCR($选择性催化还原$\rm )$工作原理:
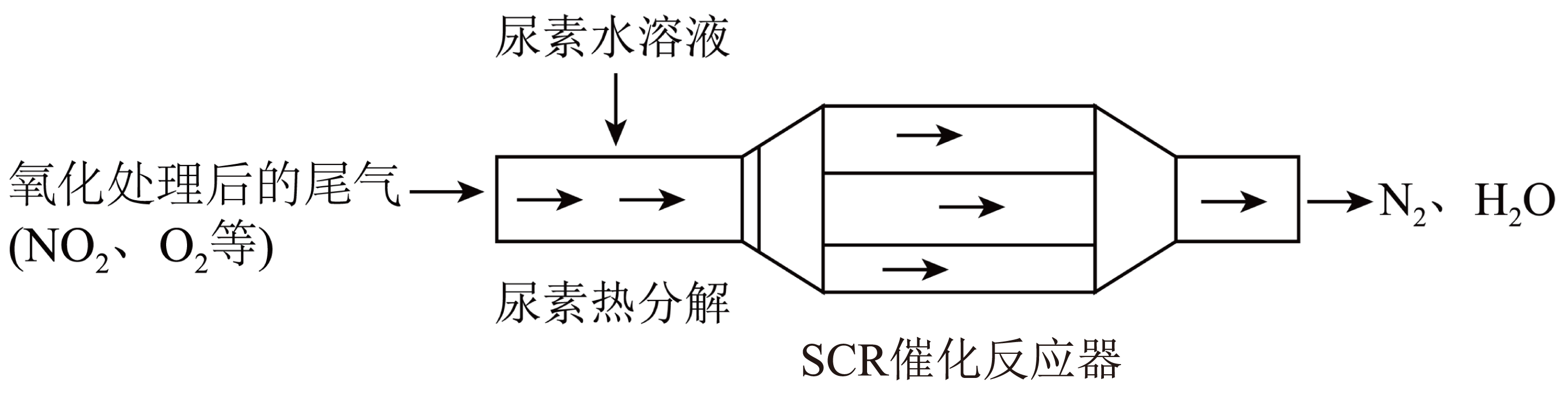
① 尿素$\rm [CO(NH_{2})_{2}]$水溶液热分解为$\rm NH_{3}$和$\rm CO_{2}$,该反应的化学方程式: 。
② 反应器中$\rm NH_{3}$还原$\rm NO_{2}$的化学方程式: 。
③ 当燃油中含硫量较高时,尾气中$\rm SO_{2}$在$\rm O_{2}$作用下会形成$\rm (NH_{4})_{2}SO_{4}$,使催化剂中毒。用化学方程式表示$\rm (NH_{4})_{2}SO_{4}$的形成: 。
④ 尿素溶液浓度影响$\rm NO_{2}$的转化,测定溶液中尿素$ (M=60\;\rm g·mol^{-1})$含量的方法如下:取$a\;\rm g$尿素溶液,将所含氮完全转化为$\rm NH_{3}$,所得$\rm NH_{3}$用过量的$ {v_{1}\;\rm mL}\; c_{1}\;\rm mol·L^{-1}\;\rm H_{2}SO_{4}$溶液吸收完全,剩余$\rm H_{2}SO_{4}$用${ v_{2}\;\rm mL}\; c_{2}\;\rm mol·L^{-1}\;\rm NaOH$溶液恰好中和,则尿素溶液中溶质的质量分数是 。
$\\rm CO(NH_{2})_{2}+H_{2}O=2NH_{3}↑+CO_{2}↑$;$\\rm 8NH_{3}+6NO_{2}\\begin{array}{*{20}{c}}{\\underline{\\underline {催化剂}} }\\\\{}\\end{array} 7N_{2}+12H_{2}O$;$\\rm 2SO_{2}+O_{2}+4NH_{3}+2H_{2}O=2(NH_{4})_{2}SO_{4}$;$\\dfrac{6{{c}_{1}}{{v}_{1}}3{{c}_{2}}{{v}_{2}}}{ {a}}$
"]]①尿素$\rm [CO(NH_{2})_{2}]$水溶液热分解为$\rm NH_{3}$和$\rm CO_{2}$,反应物为尿素和水,反应生成物为氨气和水,原子守恒书写化学方程式为:$\rm CO(NH_{2})_{2}+H_{2}O\begin{array}{*{20}{c}}{\underline{\underline {\triangle}} }\\{}\end{array} 2NH_{3}↑+CO_{2}↑$;②$\rm NH_{3}$在催化剂作用下还原$\rm NO_{2}$生成氮气和水,反应的化学方程式为$\rm 8NH_{3}+6NO_{2}\begin{array}{*{20}{c}}{\underline{\underline {催化剂}} }\\{}\end{array} 7N_{2}+12H_{2}O$;③$\rm SO_{2}$在$\rm O_{2}$作用下与$\rm NH_{3}$、$\rm H_{2}O$反应形成$\rm (NH_{4})_{2}SO_{4}$,此反应中$\rm SO_{2}$是还原剂,氧气是氧化剂,反应的化学方程式为$\rm 2SO_{2}+O_{2}+4NH_{3}+2H_{2}O= 2(NH_{4})_{2}SO_{4}$;④涉及反应为$\rm 2NH_{3}+H_{2}SO_{4}=(NH_{4})_{2}SO_{4}$,$\rm 2NaOH+H_{2}SO_{4}=Na_{2}SO_{4}+H_{2}O$,反应中${ n\rm(H_{2}SO_{4})}=v_{1}\times c_{1}\times 10^{-3}\;\rm mol$,${ n\rm(NaOH)}=v_{2}\times c_{2}\times 10^{-3}\;\rm mol$,由方程式可知${ n\rm(NaOH)}+n{\rm(NH_{3})}=2n\rm(H_{2}SO_{4})$,则${ n\rm(NH_{3})}=(2v_{1}\times c_{1}\times 10^{-3}-v_{2}\times c_{2}\times 10^{-3})\rm\;mol$,则${ m\rm(CO(NH_{2})_{2})}=\dfrac{1}{2} \times (2v_{1}\times c_{1}\times 10^{-3}-v_{2}\times c_{2}\times 10^{-3}){\rm \;mol\times 60\;\rm g/mol}=(0.06v_{1}c_{1}-0.03v_{2}c_{2} )\rm\;g$,尿素溶液中溶质的质量分数是$\dfrac{0.06{{{c}}_{1}}{{{V}}_{1}}-0.03{{{c}}_{2}}{{{V}}_{2}}}{{a}} \times 100=\dfrac{6{{{c}}_{1}}{{{V}}_{1}}-3{{{c}}_{2}}{{{V}}_{2}}}{{a}}$;
${\rm NSR(NO}_{x}$储存还原$\rm )$工作原理:${\rm NO}_{x}$的储存和还原在不同时段交替进行,如图$\rm a$所示。
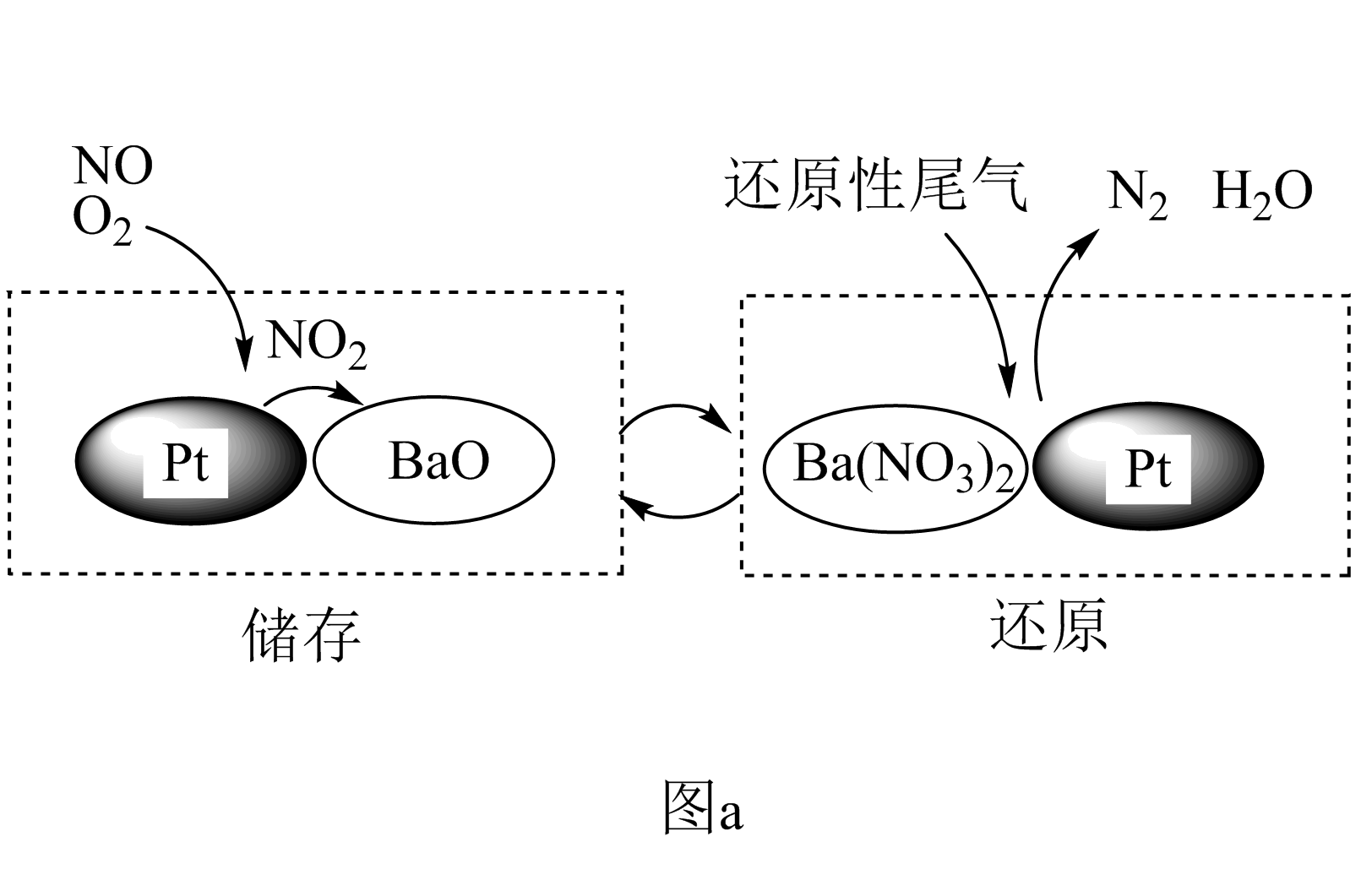
①通过$\rm BaO$和$\rm Ba(NO_{3})_{2}$的相互转化实现${\rm NO}_{x}$的储存和还原。储存${\rm NO}_{x}$的物质是 。
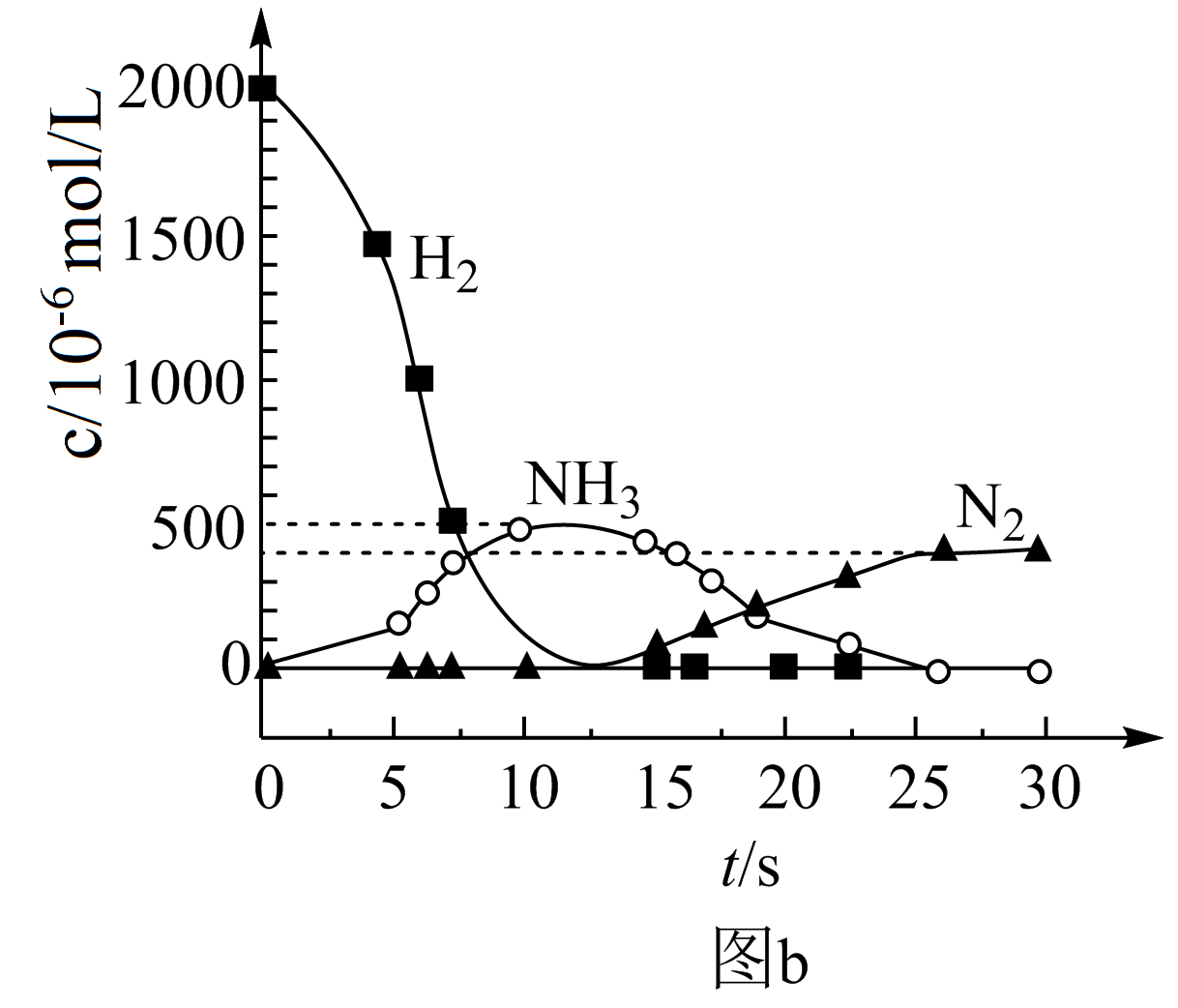
② 用$\rm H_{2}$模拟尾气中还原性气体研究了$\rm Ba(NO_{3})_{2}$的催化还原过程,该过程分两步进行,图$\rm b$表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的$\rm H_{2}$与$\rm Ba(NO_{3})_{2}$的物质的量之比是 。
③ 还原过程中,有时会产生笑气$\rm (N_{2}O)$。用同位素示踪法研究发现笑气的产生与$\rm NO$有关。在有氧条件下$\rm ^{15}NO$与$\rm NH_{3}$以一定比例反应时,得到的笑气几乎都是$\rm ^{15}NNO$。将该反应的化学方程式补充完整: $\begin{array}{*{20}{c}}{\underline{\underline {催化剂}} }\\{}\end{array} $ $\rm ^{15}NNO+$ $\rm H_{2}O$
$\\rm BaO$;$\\rm 8: 1$;$\\rm 4^{15}NO+4NH_{3}+3O_{2}$;$\\rm 4$;$\\rm 6$
"]]①由图示可知$\rm BaO$和${\rm NO}_{x}$反应生成$\rm Ba(NO_{3})_{2}$,$\rm Ba(NO_{3})_{2}$再还原为$\rm N_{2}$,则储存${\rm NO}_{x}$的物质为$\rm BaO$;②第一步反应中$\rm H_{2}$被氧化生成水,化合价由$\rm 0$价升高到$\rm +1$价,$\rm Ba(NO_{3})_{2}$的$\rm N$元素化合价由$\rm +5$价降低到$\rm -3$价,生成氨气,则$\rm 1\;\rm mol\;\rm Ba(NO_{3})_{2}$生成氨气转移$\rm 16\;\rm mol$电子,参加反应的氢气的物质的量为$\dfrac{16}{2}\;\rm mol =8\;\rm mol$,则消耗的$\rm H_2$与$\rm Ba(NO_{3})_{2}$的物质的量之比是$\rm 8: 1$;③在有氧条件下$\rm ^{15}NO$与$\rm NH_{3}$以一定比例反应时,得到的笑气几乎都是$\rm ^{15}NNO$,由$\rm N$元素守恒可知$\rm ^{15}NO$与$\rm NH_{3}$应为$\rm 1:1$,可知反应的化学方程式为$\rm 4^{15}NO+4NH_{3}+3O_{2 }\begin{array}{*{20}{c}}{\underline{\underline {催化剂}} }\\{}\end{array} 4^{15}NNO+6H_{2}O$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
