高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
高铁酸钾$\left( {{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}} \right)$是一种新型净水剂,制备流程如下:
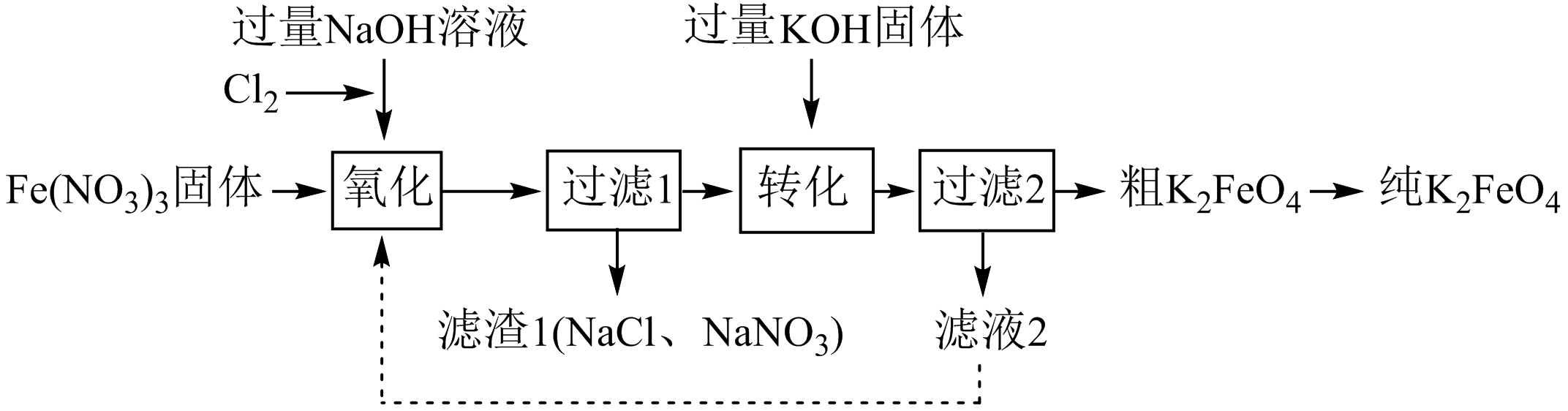
资料:$\rm I$.$\rm {{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$可溶于水,微溶于$\rm \text{KOH}$溶液,难溶于乙醇。$\text{KOH}$易溶于乙醇。
Ⅱ.$\text{FeO}_{4}^{2-}$在碱性溶液中稳定,中性和酸性溶液中不稳定。
${{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$具有强氧化性,其中铁元素的化合价为 价。
$\\rm +6$
"]]${{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$中$\rm K$和$\rm O$的化合价分别是$\rm +1$价和$\rm -2$价,依据化合价代数和为$\rm 0$可知其中铁元素的化合价为$\rm +6$价;
$\text{C}{{\text{l}}_{2}}$与$\text{NaOH}$溶液反应生成$\text{NaClO}$的离子方程式是 。
$\\text{C}{{\\text{l}}_{2}}+2\\text{O}{{\\text{H}}^{-}}=\\text{C}{{\\text{l}}^{-}}+\\text{Cl}{{\\text{O}}^{-}}+{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]$\text{C}{{\text{l}}_{2}}$与$\text{NaOH}$溶液反应生成$\text{NaClO}$和水,反应的离子方程式为:$\text{C}{{\text{l}}_{2}}+2\text{O}{{\text{H}}^{-}}=\text{C}{{\text{l}}^{-}}+\text{Cl}{{\text{O}}^{-}}+{{\text{H}}_{\text{2}}}\text{O}$;
补全“氧化”中反应的离子方程式 :
$\square \text{Cl}{{\text{O}}^{-}}+\square \text{F}{{\text{e}}^{3+}}+\square $ $=\square \text{FeO}_{4}^{2-}+\square $ $+\square $ 。
$\\text{3Cl}{{\\text{O}}^{-}}+2\\text{F}{{\\text{e}}^{3+}}+10\\text{O}{{\\text{H}}^{-}}=2\\text{FeO}_{4}^{2-}+3\\text{C}{{\\text{l}}^{-}}+5{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]反应中氯元素化合价从$\rm +1$价降低到$\rm -1$价得到$\rm 2$个电子,铁元素化合价从$\rm +3$价升高到$\rm +6$价,失去$\rm 3$个电子,根据电子得失守恒、原子守恒以及电荷守恒可知反应的离子方程式为:$\text{3Cl}{{\text{O}}^{-}}+2\text{F}{{\text{e}}^{3+}}+10\text{O}{{\text{H}}^{-}}=2\text{FeO}_{4}^{2-}+3\text{C}{{\text{l}}^{-}}+5{{\text{H}}_{\text{2}}}\text{O}$;
下列说法正确的是 。
$\rm a$.“氧化”中$\rm \text{NaOH}$溶液过量的目的是使$\rm \text{FeO}_{4}^{2-}$稳定存在
$\rm b$.“转化”中生成$\rm {{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$固体
$\rm c$.设计物质循环的目的是提高原料的利用率
$\\rm abc$
"]]$\rm a$.根据题干信息,$\rm \text{FeO}_{4}^{2-}$在碱性溶液中稳定,所以“氧化”中$\rm \text{NaOH}$溶液过量的目的是使$\rm \text{FeO}_{4}^{2-}$稳定存在,$\rm a$正确;
$\rm b$. “转化”中钠盐转化为钾盐,即生成$\rm {{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$固体,$\rm b$正确;
$\rm c$.滤液$\rm 2$中含有氢氧化钠,可以循环利用,则设计物质循环的目的是提高原料的利用率,$\rm c$正确;
答案选$\rm abc$;
粗${{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$转化为纯${{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$的操作包含洗涤,去除固体表面的$\text{KOH}$,可以用 洗涤。
乙醇
"]]由于${{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$可溶于水,微溶于$\rm KOH$溶液,难溶于乙醇,$\rm KOH$易溶于乙醇,所以去除固体表面的$\rm KOH$,可以用乙醇洗涤;
已知:${{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$与稀硫酸反应生成$\text{F}{{\text{e}}^{3+}}$和${{\text{O}}_{2}}$。取$ {m\;\rm g}{{\text{ K}}_{2}}\text{Fe}{{\text{O}}_{4}}$产品,加入稀硫酸充分反应,测得生成${{\text{O}}_{2}}$的体积为$ {v\;\rm mL}\rm ($标准状况$\rm )$。$\left[ {M}\left( {{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}} \right)=198\;\text{g}/\text{mol} \right]$
①${{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$的纯度$\rm =$ 。$\rm ($列计算式$\rm )($物质的纯度$=\dfrac{物质的质量}{样品的质量}\times 100\%\rm )$
②若将稀硫酸换成稀盐酸,生成的气体中含有$\text{C}{{\text{l}}_{2}}$,导致${{\text{K}}_{2}}\text{Fe}{{\text{O}}_{4}}$的纯度的计算值偏大,原因是 。
$\\dfrac{\\dfrac{4}{3}\\times 198{v}\\times {{10}^{-3}}}{{22}{.4 m}}\\times 100\\%$;$\\rm Cl^{- }$被$\\rm {{{K}}_{2}}{Fe}{{{O}}_{4}}$氧化生成$\\rm Cl_{2}$,生成$\\rm 1\\;\\rm mol\\;\\rm Cl_{2}$转移$\\rm 2\\;\\rm mol$电子,而生成$\\rm 1\\;\\rm mol\\;\\rm O_{2}$转移$\\rm 4\\;\\rm mol$电子,所以当转移电子数相同时,生成$\\rm Cl_{2}$,气体的物质的量增大,计算值偏大
"]]①$\rm {{{K}}_{2}}{Fe}{{{O}}_{4}}$与稀硫酸反应生成$\rm Fe^{3+}$和$\rm O_{2}$,离子方程式为$\rm 4FeO_{4}^{2-}\rm +20H^{+}=4Fe^{3+}+3O_{2}↑+10H_{2}O$,测得生成$\rm O_{2}$的体积为$ v\;\rm mL($标准状况$\rm )$,因此$\rm {{{K}}_{2}}{Fe}{{{O}}_{4}}$的纯度为:$\dfrac{\dfrac{4}{3}\times \dfrac{{v}\times {{10}^{-3}}{\rm \;L}}{22.4{\;\rm L}/{\rm mol}}\times 198\rm \;{g}/{mol}}{{m\rm \;g}}\times 100\%=\dfrac{\dfrac{4}{3}\times 198{v}\times {{10}^{-3}}}{{22}{.4 m}}\times 100\%$;
②由于$\rm Cl^{-}$被$\rm {{{K}}_{2}}{Fe}{{{O}}_{4}}$氧化生成$\rm Cl_{2}$,生成$\rm 1\;\rm mol\;\rm Cl_{2}$转移$\rm 2\;\rm mol$电子,而生成$\rm 1\;\rm mol\;\rm O_{2}$转移$\rm 4\;\rm mol$电子,所以当转移电子数相同时,生成$\rm Cl_{2}$,气体的物质的量增大,计算值偏大。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
