高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
探究$\rm Na_{2}SO_{3}$固体的热分解产物。
资料:①$\rm 4Na_{2}SO_{3}\begin{array}{*{20}{c}}{\underline{\underline {\triangle}} }\\{}\end{array} Na_{2}S+3Na_{2}SO_{4}$②$\rm Na_{2}S$能与$\rm S$反应生成${\rm Na_{2}S}_{x}$,${\rm Na_{2}S}_{x}$与酸反应生成$\rm S$和$\rm H_{2}S$。③$\rm BaS$易溶于水。
隔绝空气条件下,加热无水$\rm Na_{2}SO_{3}$固体得到黄色固体$\rm A$,过程中未检测到气体生成。黄色固体$\rm A$加水得到浊液,放置得无色溶液$\rm B$。
检验分解产物$\rm Na_{2}S$:取少量溶液$\rm B$,向其中滴加$\rm CuSO_{4}$溶液,产生黑色沉淀,证实有$\rm S^{2-}$。反应的离子方程式是 。
$\\rm S^{2-}+Cu^{2+}=CuS↓$
"]]$\rm Na_{2}S$和$\rm CuSO_{4}$溶液反应生成硫化铜和硫酸钠,反应的离子方程式是$\rm S^{2-}+Cu^{2+}=CuS↓$;
检验分解产物$\rm Na_{2}SO_{4}$:取少量溶液$\rm B$,滴加$\rm BaCl_{2}$溶液,产生白色沉淀,加入盐酸,沉淀增多$\rm ($经检验该沉淀含$\rm S)$,同时产生有臭鸡蛋气味的气体$\rm (H_{2}S)$,由于沉淀增多对检验造成干扰,另取少量溶液$\rm B$,加入足量盐酸,离心沉降$\rm ($固液分离$\rm )$后, $\rm ($填操作和现象$\rm )$,可证实分解产物中含有$\rm SO_{4}^{2-}$。
滴加$\\rm BaCl_{2}$溶液,产生白色沉淀,
"]]根据题干资料:$\rm Na_{2}S$能与$\rm S$反应生成${\rm Na_{2}S}_{x}$,${\rm Na_{2}S}_{x}$与酸反应生成$\rm S$和$\rm H_{2}S$,取少量溶液$\rm B$,滴加$\rm BaCl_{2}$溶液,产生白色沉淀,加入盐酸,沉淀增多$\rm ($经检验该沉淀含$\rm S)$,同时产生有臭鸡蛋气味的气体$\rm (H_{2}S)$,说明$\rm B$溶液中含有${\rm Na_{2}S}_{x}$,${\rm Na_{2}S}_{x}$与酸反应生成$\rm S$和$\rm H_{2}S$,由于沉淀增多对检验造成干扰,另取少量溶液$\rm B$,加入足量盐酸,离心沉降$\rm ($固液分离$\rm )$后,滴加$\rm BaCl_{2}$溶液,产生白色沉淀,可证实分解产物中含有$\rm SO_{4}^{2-}$;
探究$(2)$中$\rm S$的来源。
来源$\rm 1$:固体$\rm A$中有未分解的$\rm Na_{2}SO_{3}$,在酸性条件下与$\rm Na_{2}S$反应生成$\rm S$。
来源$\rm 2$:溶液$\rm B$中有${\rm Na_{2}S}_{x}$,加酸反应生成$\rm S$。
针对来源$\rm 1$进行如图实验:
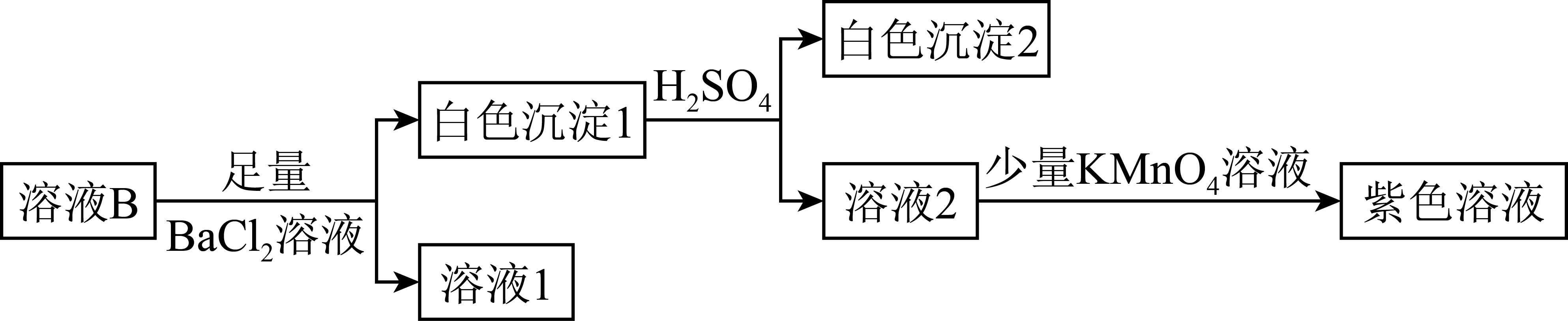
①实验可证实来源$\rm 1$不成立。实验证据是 。
②不能用盐酸代替硫酸的原因是 。
③写出来源$\rm 2$产生$\rm S$的反应的离子方程式: 。
向溶液$\\rm 2$中加入$\\rm KMnO_{4}$溶液,溶液没有褪色;盐酸中$\\rm Cl$元素为$\\rm -1$价,是$\\rm Cl$元素的最低价,具有还原性,会与$\\rm KMnO_{4}$溶液发生氧化还原反应,使$\\rm KMnO_{4}$溶液应该褪色,干扰实验现象和实验结论;${\\rm S}_{x}^{2-}+{\\rm 2H^{+}=H_{2}S}↑+(x-1)\\rm S↓$
"]]①实验可证实来源$\rm 1$不成立。根据分析,溶液$\rm 2$为$\rm H_{2}SO_{3}$,向溶液$\rm 2$中加入少量$\rm KMnO_{4}$溶液,$\rm H_{2}SO_{3}$具有还原性,酸性条件下$\rm KMnO_{4}$具有强氧化性,二者混合和后应发生氧化还原反应,$\rm KMnO_{4}$溶液应该褪色,但得到的仍为紫色,说明溶液$\rm B$中不含$\rm Na_{2}SO_{3}$;
②不能用盐酸代替硫酸的原因是盐酸中$\rm Cl$元素为$\rm -1$价,是$\rm Cl$元素的最低价,具有还原性,会与$\rm KMnO_{4}$溶液发生氧化还原反应,使$\rm KMnO_{4}$溶液应该褪色,干扰实验现象和实验结论;
③来源$\rm 2$认为溶液$\rm B$中有${\rm Na_{2}S}_{x}$,加酸反应生成$\rm S$,反应的离子方程式:${\rm S}_{x}^{2-}+{\rm 2H^{+}=H_{2}S}↑+(x-1)\rm S↓$;
实验证明$\rm Na_{2}SO_{3}$固体热分解有$\rm Na_{2}S$,$\rm Na_{2}SO_{4}$和$\rm S$产生。运用氧化还原反应规律分析产物中$\rm S$产生的合理性: 。
根据反应$\\rm 4Na_{2}SO_{3}\\begin{array}{*{20}{c}}{\\underline{\\underline {\\triangle}} }\\\\{}\\end{array} Na_{2}S+3Na_{2}SO_{4}$发生歧化反应,其中的$\\rm S$元素化合价即可升高也可降低,能从$\\rm +4$价降为$\\rm -2$价,也应该可以降到$\\rm 0$价生成硫单质
"]]根据已知资料:$\rm 4Na_{2}SO_{3}\begin{array}{*{20}{c}}{\underline{\underline {\triangle}} }\\{}\end{array} Na_{2}S+3Na_{2}SO_{4}$,亚硫酸钠中硫为$\rm +4$价,硫酸钠中硫为$\rm +6$价,硫化钠中硫为$\rm -2$价,根据反应可知$\rm Na_{2}SO_{3}$发生歧化反应,其中的$\rm S$元素化合价即可升高也可降低,能从$\rm +4$价降为$\rm -2$价,也应该可以降到$\rm 0$价生成硫单质。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
