高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
钒($\rm _{23}V$)广泛用于催化及钢铁工业。回答下列问题:
钒在元素周期表中的位置为 ,其价层电子排布式为 。
第四周期$\\rm VB$族; $\\rm 3d^{3}4s^{2}$
"]]由题干信息可知,$\rm V$是$\rm 23$号元素,其核外电子排布式为:$\rm [Ar]3d^{3}4s^{2}$,故钒在元素周期表中的位置为第四周期$\rm VB$族,其价层电子排布式为$\rm 3d^{3}4s^{2}$;
${{\text{V}}_{\text{2}}}{{\text{O}}_{\text{5}}}$常用作$\text{S}{{\text{O}}_{\text{2}}}$转化为$\text{S}{{\text{O}}_{3}}$的催化剂。$\text{S}{{\text{O}}_{\text{2}}}$分子中$\rm S$原子价层电子对数是 对,分子的立体构型为 ;$\text{S}{{\text{O}}_{3}}$气态为单分子,该分子中$\rm S$原子的杂化轨道类型为 ;$\text{S}{{\text{O}}_{3}}$的三聚体环状结构如图所示,该结构中$\rm S$原子的杂化轨道类型为 ;该结构中$\rm S-O$键长由两类,一类键长约$\rm 140\ pm$,另一类键长约为$\rm 160\ pm$,较短的键为 (填图中字母),该分子中含有 个$\rm \sigma$键。
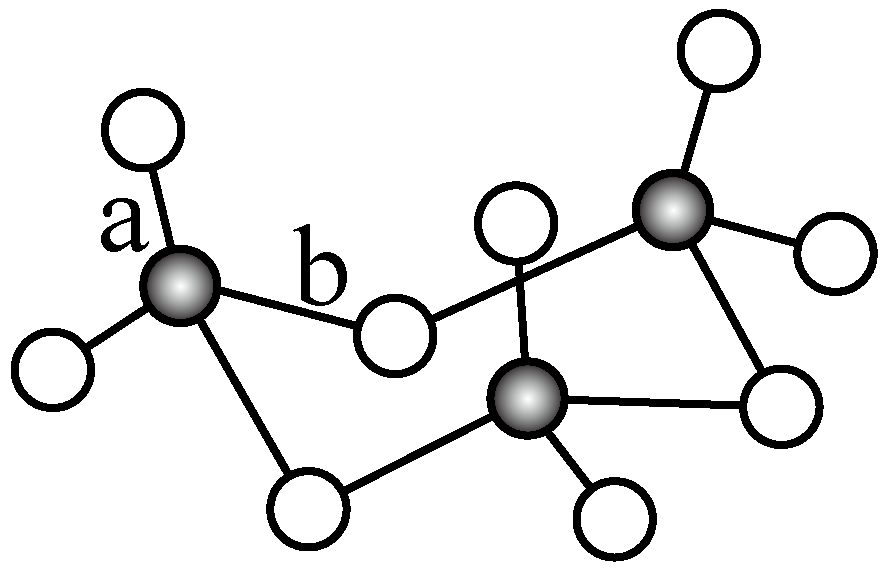
$\\rm 3$; $\\rm V$形; $\\rm sp^{2}$杂化; $\\rm sp^{3}$杂化; $\\rm a$ ;$\\rm 12$
"]]$\rm SO_{2}$分子中$\rm S$原子价层电子对数是$\rm 2+\dfrac{\text{1}}{\text{2}}\rm (6-2\times 2)=3$对,根据价层电子对互斥理论可知,其分子的立体构型为$\rm V$形;$\rm SO_{3}$气态为单分子,该分子中$\rm S$原子周围的价层电子对数为:$\rm 3+\dfrac{\text{1}}{\text{2}}\rm (6-3\times 2)=3$,根据杂化轨道理论可知,$\rm S$的杂化轨道类型为$\rm sp^{2}$;由题干$\rm SO_{3}$的三聚体环状结构图可知,该结构中$\rm S$原子周围形成$\rm 4$个$\rm \sigma$键,没有孤电子对,即价层电子对数为$\rm 4$,该$\rm S$原子的杂化轨道类型为$\rm sp^{3}$;根据$\rm S$原子最外层上有$\rm 6$个电子可知,该结构中$\rm a$将为$\rm S=O$键,$\rm b$键为$\rm S-O$键,已知相同原子形成双键比单键更短,故$\rm S-O$键长由两类,一类键长约$\rm 140\ pm$,另一类键长约为$\rm 160\ pm$,较短的键为$\rm a$,已知单键均为$\rm \sigma$键,双键是$\rm 1$个$\rm \sigma$键和$\rm 1$个$\rm \pi$键,故该分子中含有$\rm 12$个$\rm \sigma$键;
钒的某种氧化物的晶胞结构如图所示。晶胞中实际拥有的阴、阳离子个数分别为 、 。
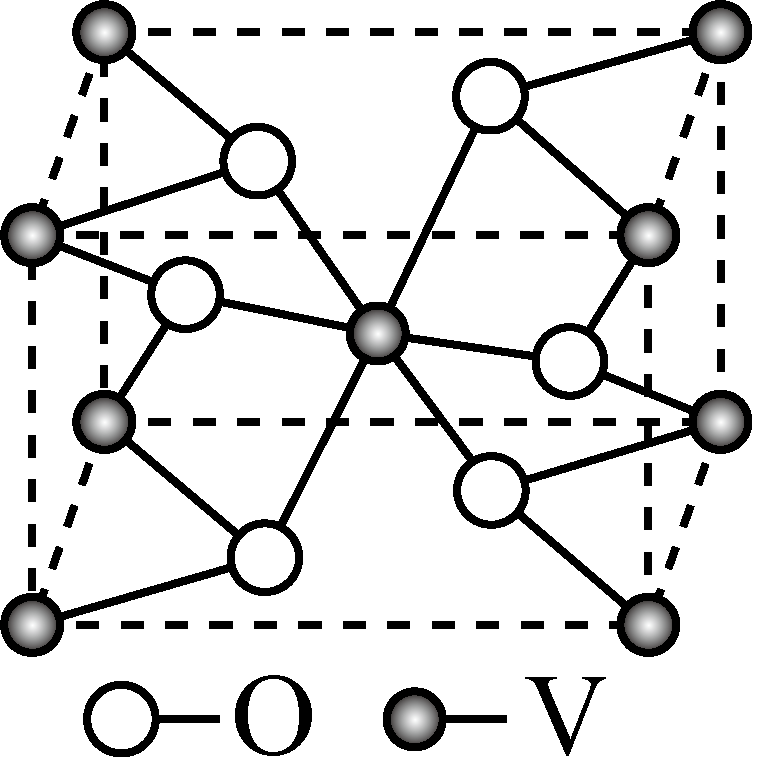
$\\rm 4$ ;$\\rm 2$
"]]由题干钒的某种氧化物的晶胞结构图可知,根据均摊法可计算,晶胞中实际拥有的阴即$\rm O^{2-}$个数为:$\text{4 }\!\!\times\!\!\text{ }\dfrac{\text{1}}{\text{2}}\text{+2}\rm =4$、阳离子个数为:$\text{8 }\!\!\times\!\!\text{ }\dfrac{\text{1}}{\text{8}}\text{+1}\rm =2$;
$\rm V_{2}O_{5}$溶解在$\rm NaOH$溶液中,可得到钒酸钠($\rm Na_{3}VO_{4}$),该盐阴离子的立体构型为 ;也可以得到偏钒酸钠,其阴离子呈如图所示的无限链状结构,则偏钒酸钠的化学式为 。
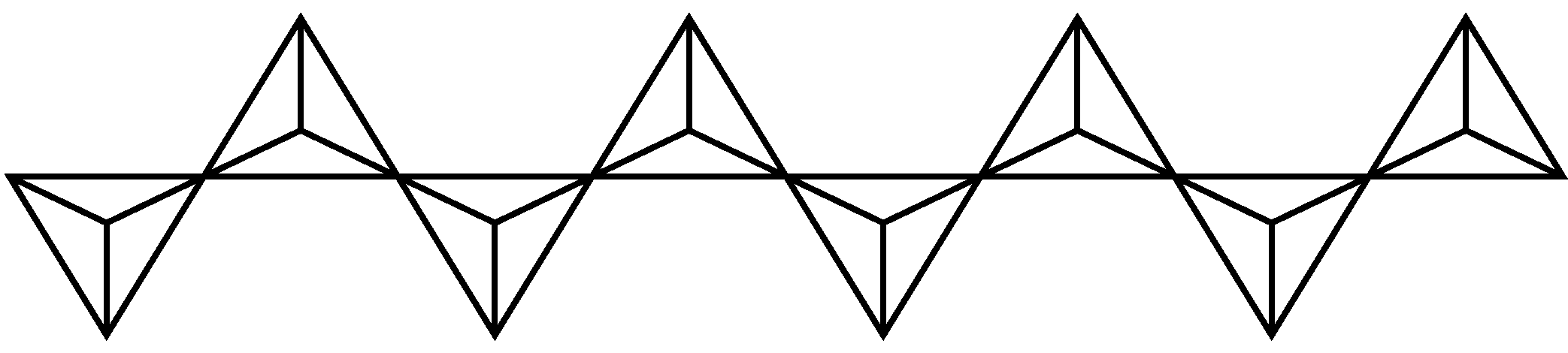
正四面体形 ;$\\rm NaVO_{3}$
"]]$\rm V_{2}O_{5}$溶解在$\rm NaOH$溶液中,可得到钒酸钠($\rm Na_{3}VO_{4}$),该盐阴离子即$\text{VO}_{\text{4}}^{\text{3-}}$中心原子$\rm V$周围的价层电子对数为:$\rm 4+\dfrac{\text{1}}{\text{2}}\rm (5+3-4\times 2)=4$,没有孤电子对,根据价层电子对互斥理论可知,该阴离子的立体构型为正四面体形;由题干偏钒酸钠中阴离子无限链状结构图可知,每个$\rm V$与$\rm 3$个$\rm O$形成阴离子,且$\rm V$的化合价为$\rm +5$价,则形成的化合物化学式为$\rm NaVO_{3}$,则偏钒酸钠的化学式为$\rm NaVO_{3}$;
全钒液流电池是具有发展前景的、用作储能系统的蓄电池,已知放电时$\rm V^{2+}$发生氧化反应,电池原理(电解液中含$\rm H_{2}SO_{4}$)如图:
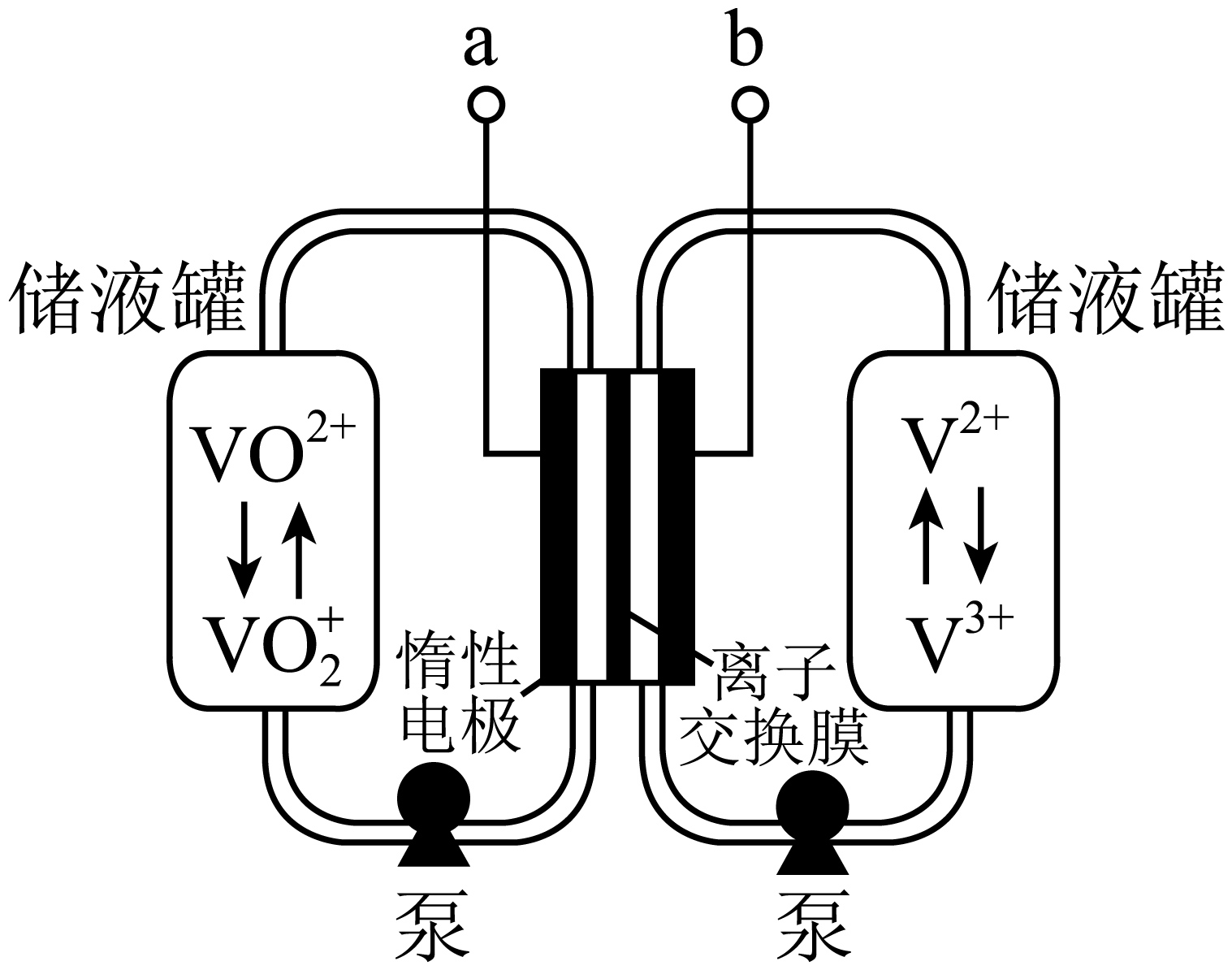
①$\rm a$是 (填“正极”或“负极”)。
②该蓄电池反应方程式为 (标出“充电”“放电”方向)。
正极; $\\rm V^{2+}+\\text{VO}_{\\text{2}}^{+}\\rm +2H^{+}\\underset{\\text{充电}}{\\overset{\\text{放电}}{\\mathop{\\rightleftharpoons }}}\\, \\rm VO^{2+}+V^{3+}+H_{2}O$
"]]①由题干信息可知,放电时$\rm V^{2+}$发生氧化反应,即放电时$\rm b$电极发生氧化反应,即$\rm b$为负极,电极反应为:$\rm V^{2+}-e^{-}=V^{3+}$,则$\rm a$为正极,发生还原反应,电极反应为:$\rm V^{2+}+\text{VO}_{\text{2}}^{+}\rm +2H^{+}\underset{\text{充电}}{\overset{\text{放电}}{\mathop{\rightleftharpoons }}}\, \rm VO^{2+}+V^{3+}+H_{2}O$。
高中 | 杂化轨道理论题目答案及解析(完整版)
