高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\text{C}{{\text{O}}_{\text{2}}}$的吸收和资源化受到越来越多的关注。
常温下,将一定量的$\text{C}{{\text{O}}_{\text{2}}}$通入石灰乳中充分吸收,达平衡后,溶液的$\rm pH$为$\rm 11$,则$c\left( \text{CO}_{3}^{2-} \right)=$ 。$\rm ($已知:${{K}_{\text{sp}}}\left[ \text{Ca}{{\left( \text{OH} \right)}_{2}} \right]=5.6\times {{10}^{-6}}$,${{K}_{\text{sp}}}\left( \text{CaC}{{\text{O}}_{\text{3}}} \right)=2.8\times {{10}^{-9}}\rm )$
$5\\times {{10}^{-10}}\\;\\rm \\text{mol}\\cdot {{\\text{L}}^{-1}}$
"]]常温下,将一定量的$\text{C}{{\text{O}}_{\text{2}}}$通入石灰乳中充分吸收,达平衡后,溶液的$\rm pH$为$\rm 11$,依据${{K}_{\text{sp}}}\left[ \text{Ca}{{\left( \text{OH} \right)}_{2}} \right]=5.6\times {{10}^{-6}}$可知钙离子浓度是$\dfrac{5.6\times {{10}^{-6}}}{{{0.001}^{2}}}\text{mol/L}=5.6\,\text{mol/L}$,因此根据${{K}_{\text{sp}}}\left( \text{CaC}{{\text{O}}_{\text{3}}} \right)=2.8\times {{10}^{-9}}$可知$c\left( \text{CO}_{3}^{2-} \right)=\dfrac{2.8\times {{10}^{-9}}}{5.6}\ \text{mol/L}=5\times {{10}^{-1}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}^{0}$。
$\text{C}{{\text{O}}_{\text{2}}}$催化加氢合成$\text{C}{{\text{H}}_{4}}$。$1\,\text{mol}\,\text{C}{{\text{O}}_{\text{2}}}$反应生成$\text{C}{{\text{H}}_{4}}$和${{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)$时放出$\rm 252.9$ $\rm kJ$的热量,写出该反应的热化学方程式 。
$\\text{C}{{\\text{O}}_{\\text{2}}}\\left( \\text{g} \\right)+4{{\\text{H}}_{2}}\\left( \\text{g} \\right)=\\text{C}{{\\text{H}}_{4}}\\left( \\text{g} \\right)+2{{\\text{H}}_{\\text{2}}}\\text{O}\\left( \\text{g} \\right)\\quad \\Delta H=-252.9\\,\\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{-\\text{1}}}$
"]]$\rm 1$ $\rm mol$ $\text{C}{{\text{O}}_{\text{2}}}$反应生成$\text{C}{{\text{H}}_{4}}$和${{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)$时放出$\rm 252.9$ $\rm kJ$的热量,则该反应的热化学方程式为$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+4{{\text{H}}_{2}}\left( \text{g} \right)=\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+2{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta H=-252.9\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-\text{1}}}$。
$\text{C}{{\text{O}}_{\text{2}}}$电解制$\text{C}{{\text{H}}_{4}}$。下图表示$\text{C}{{\text{O}}_{\text{2}}}$在$\rm Cu$电极上转化为$\text{C}{{\text{H}}_{4}}$,该电极反应式为 。
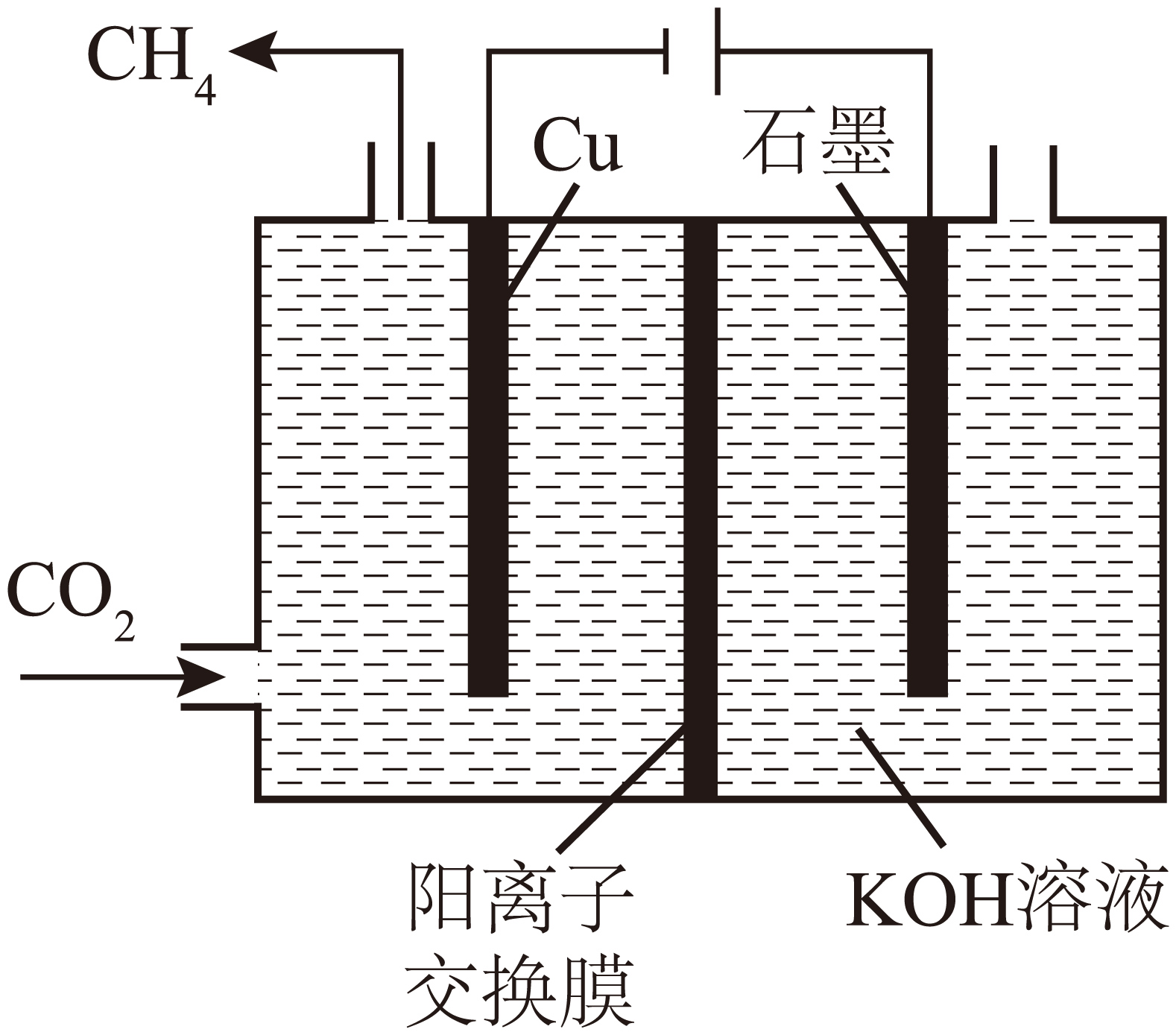
$\\text{C}{{\\text{O}}_{\\text{2}}}\\text{+8}{{\\text{e}}^{-}}\\text{+6}{{\\text{H}}_{\\text{2}}}\\text{O=C}{{\\text{H}}_{\\text{4}}}\\text{+8O}{{\\text{H}}^{-}}$
"]]铜电极和电源负极相连,作阴极,发生得到电子的还原反应,则$\text{C}{{\text{O}}_{\text{2}}}$在$\rm Cu$电极上转化为$\text{C}{{\text{H}}_{4}}$的电极反应式为$\text{C}{{\text{O}}_{\text{2}}}\text{+8}{{\text{e}}^{-}}\text{+6}{{\text{H}}_{\text{2}}}\text{O=C}{{\text{H}}_{\text{4}}}\text{+8O}{{\text{H}}^{-}}$。
$\text{C}{{\text{O}}_{\text{2}}}$和${{\text{H}}_{2}}$可直接合成甲醇。$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{\text{1}}}$ 。
①若保持容积不变,测得两种不同温度时$\text{C}{{\text{H}}_{\text{3}}}\text{OH}$的物质的量随时间的变化如图所示,则$\Delta {{H}_{1}}$ $\rm 0($填“$\rm \gt $”或“$\rm \lt $”$\rm )$。
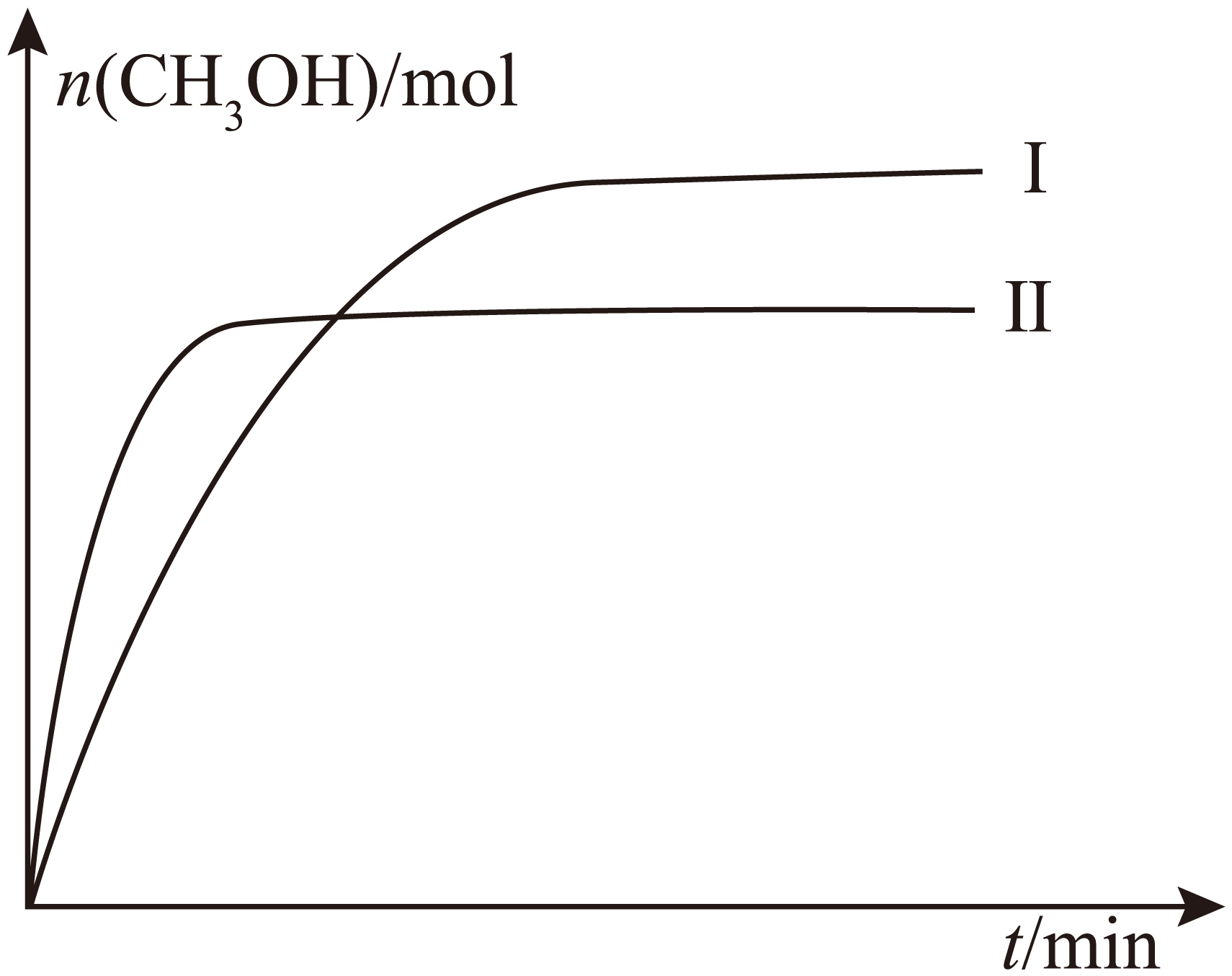
②在恒温恒容密闭容器中,$\text{C}{{\text{O}}_{\text{2}}}$和${{\text{H}}_{2}}$的起始浓度分别为$m\,\text{mol}\cdot {{\text{L}}^{-\text{1}}}$和$3 m\,\text{mol}\cdot {{\text{L}}^{-\text{1}}}$,反应平衡时,$\text{C}{{\text{H}}_{\text{3}}}\text{OH}$的产率为$n$,该温度下反应平衡常数的值为 。
$\\rm \\lt $ ; $\\dfrac{{{n}^{2}}}{27\\;{{m}^{2}}{{\\left( 1-n \\right)}^{4}}}$
"]]①曲线Ⅱ对应的反应首先达到平衡状态,说明该曲线对应的温度高,温度高,甲醇的物质的量小,说明升高温度平衡逆向移动,正反应是放热反应,$\Delta {{H}_{\text{1}}}\lt 0$;
②依据三段式可知$\rm ($单位是$\text{mol}\cdot {{\text{L}}^{-\text{1}}}\rm )$
$\begin{matrix} {} & \text{C}{{\text{O}}_{\text{2}}} & + & 3{{\text{H}}_{2}} & \rightleftharpoons & \text{C}{{\text{H}}_{\text{3}}}\text{OH} & + & {{\text{H}}_{\text{2}}}\text{O} & {} & {} \\ 始& m & {} & 3 m & {} & 0 & {} & 0 & {} & {} \\变 & mn & {} & 3 mn & {} & mn & {} & mn & {} & {} \\平 & m-mn & {} & 3 m-3 mn & {} & mn & {} & mn & {} & {} \\ \end{matrix}$
该温度下反应平衡常数的值为$\dfrac{mn\times mn}{(m-mn)\times {{(3 m-3 mn)}^{3}}}=\dfrac{{{n}^{2}}}{27 {{m}^{2}}{{\left( 1-n \right)}^{4}}}$。
$\text{C}{{\text{O}}_{\text{2}}}$与$\text{C}{{\text{H}}_{4}}$催化重整可得$\rm CO$和${{\text{H}}_{2}}$。其中有两个过程,如下表。
| 过程 | 反应 | $\Delta H$ |
| 积碳反应 | $\text{C}{{\text{H}}_{4}}\left( \text{g} \right)=\text{C}\left( \text{s} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)$ | $\Delta {{H}_{2}}=+75\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-\text{1}}}$ |
| 消碳反应 | $\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+\text{C}\left( \text{s} \right)=2\text{CO}\left( \text{g} \right)$ | $\Delta {{H}_{3}}=+172\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-\text{1}}}$ |
催化剂表面的积碳量随温度的变化如图所示。
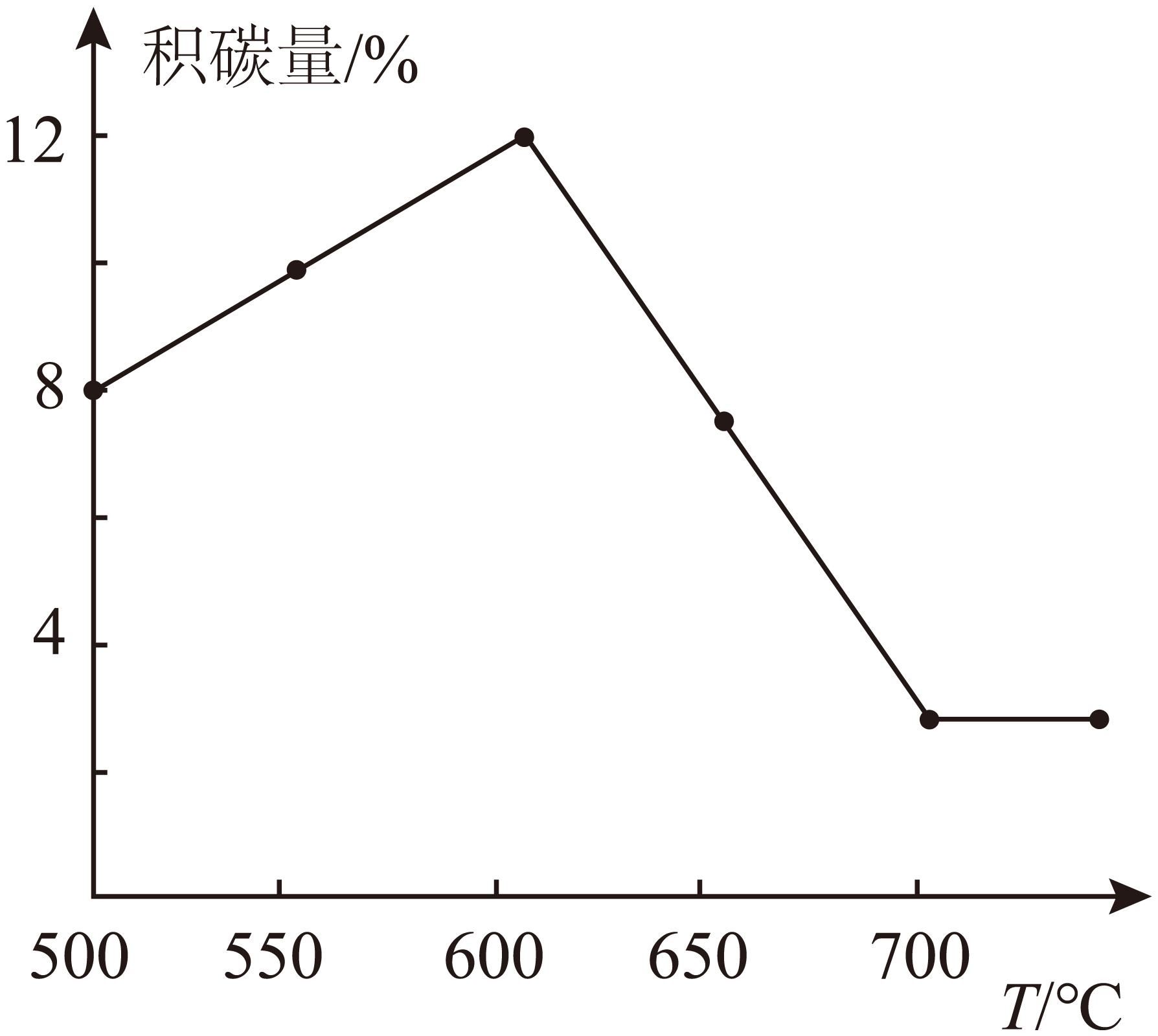
①试解释消碳反应在一定条件下能自发进行的原因是 。
②试解释随温度的升高积碳量变化的原因。
$\rm a$.低于$\rm 600\;\rm ^\circ\rm C$: ;$\rm b$.$\rm 600\;\rm ^\circ\rm C$~$\rm 700\;\rm ^\circ\rm C$: ;$\rm c$.高于$\rm 700\;\rm ^\circ\rm C$: 。
③请提出一种清除催化剂表面积碳的方法 。
$\\Delta S\\gt 0$ ; 低于$\\rm 600\\;\\rm ^\\circ\\rm C$:积碳反应该反应吸热,随着温度升高,反应速率逐渐加快,消碳反应反应同样吸热,需较高温度才能有效进行,温度较低时消碳速率较慢。低于$\\rm 600\\;\\rm ^\\circ\\rm C$以积碳反应为主,总体上积碳量显著提升 ; $\\rm 600\\;\\rm ^\\circ\\rm C$~$\\rm 700\\;\\rm ^\\circ\\rm C$:消碳反应速率随温度升高快速增加,逐渐超过积碳反应速率,积碳量开始减少。 ; 高于$\\rm 700\\;\\rm ^\\circ\\rm C$:从较低的温度下看,积碳反应比消碳反应速率快,活化能积碳反应较低。活化能越高的反应,速率对温度变化越敏感。温度升高使其速率快速提升,最终与积碳反应速率接近平衡,积碳量不再显著变化 ; 通入$\\text{C}{{\\text{O}}_{\\text{2}}}$并升高温度至$\\rm 600\\;\\rm ^\\circ\\rm C$以上
"]]①消碳反应是吸热的熵值增加的反应,依据$\Delta G=\Delta H-T\cdot \Delta S\lt 0$自发进行可知高温下该反应可以自发进行,因此消碳反应在一定条件下能自发进行的原因是$\Delta S\gt 0$;
②由于温度低于$\rm 600\;\rm ^\circ\rm C$时,积碳反应该反应吸热,随着温度升高,反应速率逐渐加快,消碳反应反应同样吸热,需较高温度才能有效进行,温度较低时消碳速率较慢。低于$\rm 600\;\rm ^\circ\rm C$以积碳反应为主,因此总体上积碳量显著提升;
温度在$\rm 600\;\rm ^\circ\rm C$~$\rm 700\;\rm ^\circ\rm C$时,由于消碳反应速率随温度升高快速增加,逐渐超过积碳反应速率,所以积碳量开始减少。
当温度高于$\rm 700\;\rm ^\circ\rm C$时,从较低的温度下看,积碳反应比消碳反应速率快,活化能积碳反应较低。活化能越高的反应,速率对温度变化越敏感。温度升高使其速率快速提升,最终与积碳反应速率接近平衡,从而导致积碳量不再显著变化
③根据示意图可判断清除催化剂表面积碳的方法可以是通入$\text{C}{{\text{O}}_{\text{2}}}$并升高温度至$\rm 600\;\rm ^\circ\rm C$以上。
高中 | 化学平衡常数题目答案及解析(完整版)
