高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
钒是一种重要的过渡金属,其化合物具有多样的化学性质和广泛的应用。
$\rm I$.工业上常采用碳热还原氮化法制备氮化钒$\left( \text{VN} \right)$,相关热化学方程式及平衡常数如下
①${{\text{V}}_{2}}{{\text{O}}_{3}}(\text{s})+3\text{C}(\text{s})+{{\text{N}}_{2}}(\text{g})\rightleftharpoons 2\text{VN}(\text{s})+3\text{CO}(\text{g})\ \ \Delta {{{H}}_{1}}\quad {{{K}}_{1}}$
已知反应①经由以下两个基元反应分两步完成:
②${{\text{V}}_{2}}{{\text{O}}_{3}}(\text{s})+4\text{C}(\text{s})\rightleftharpoons {{\text{V}}_{2}}\text{C}(\text{s})+3\text{CO}(\text{g})\quad \Delta {{{H}}_{2}}=+742.0\; \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\quad {{{K}}_{2}}$
③${{\text{V}}_{2}}\text{C}(\text{s})+{{\text{N}}_{2}}(\text{g})\rightleftharpoons 2\text{VN}(\text{s})+\text{C}(\text{s})\quad \Delta {{{H}}_{3}}=-304.2\; \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}\quad {{{K}}_{3}}$
反应①的$\Delta {{{H}}_{1}}=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$,该反应正向能自发进行的原因是 。
$+437.8$;$\\Delta {S}\\gt 0\\rm ($熵增或正向气体增多$\\rm )$
"]]①根据盖斯定律,反应① $\rm =$ 反应② $\rm +$ 反应③,所以$\Delta{{{H}}_{\text{1}}}{= }\Delta{{{H}}_{\text{2}}}\text{+ }\Delta{ }{{{H}}_{\text{3}}}{=742}{.0\;\rm kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}\text{+(-304}{.2\;\rm kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}{)=+437}{.8\;\rm kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
②该反应的$\Delta{ S\lt 0}$,在高温时$\Delta G=\Delta H-T \Delta S\lt 0$,反应能自发进行。
若反应①、②、③分别在不同容器中独立发生,对于一定条件下的指定反应,下列有关叙述正确的是 $\rm ($填字母$\rm )$。
$\rm a$.反应①:恒温恒容时,容器内的压强不再变化时,可判断该反应达到平衡
$\rm b$.反应②:其他条件不变时缩小容积,增大压强,再次平衡时${c}\left( \text{CO} \right)$将增大
$\rm c$.反应③:恒温恒容时,向密闭容器通入$\rm {{\text{N}}_{\text{2}}}$,则平衡向正向移动,氮气的转化率下降
$\rm d$.三个反应的平衡常数的关系是${{{K}}_{\text{1}}}={{{K}}_{\text{2}}}+{{{K}}_{\text{3}}}$,且温度升高,$K$值增大
$\\rm a$
"]]$\rm a$.反应①前后气体物质的量不相等,恒温恒容时,容器内压强不再变化,说明气体物质的量不变,反应达到平衡,$\rm a$正确;
$\rm b$.反应②平衡常数$K={c}^{\text{3}}\text{(CO)}$,温度不变平衡常数不变,其他条件不变时缩小容积,增大压强,再次平衡时$ c(\rm CO)$不变,$\rm b$错误;
$\rm c$.反应③恒温恒容通$\rm {{\text{N}}_{\text{2}}}$,反应物浓度增大,温度不变平衡常数不变,平衡时氮气浓度不变,故转化的氮气浓度增大,故无法判断氮气转化率下降,$\rm c$错误;
$\rm d$.根据盖斯定律反应① $\rm =$ 反应② $\rm +$ 反应③,平衡常数关系应为${{{K}}_{\text{1}}}={{{K}}_{\text{2}}}\times {{{K}}_{\text{3}}}$,反应①、③是放热反应,温度升高平衡逆向移动,$K$值减小,反应②是吸热反应,温度升高平衡正向移动,$K$值增大,$\rm d$错误;
工业上利用反应①制备$\text{VN}$时会产生大量有害气体$\text{CO}$,以$\text{CO}$和${{\text{H}}_{\text{2}}}$为原料可以生产甲醇,其化学反应方程式为:$\text{CO}(\text{g})+2{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}(\text{g})\ \ \Delta {H}\lt 0$。${{{T}}_{1}}$下,在$\text{2\;\rm L}$恒容密闭容器中充入$\text{2\;\rm mol\;\rm CO}$和$4\;\rm \text{mol}{{\text{H}}_{2}}$合成$\text{C}{{\text{H}}_{3}}\text{OH}(\text{g})$,测得$\text{CO}$的物质的量浓度随反应时间的变化如图$\rm 1$所示:
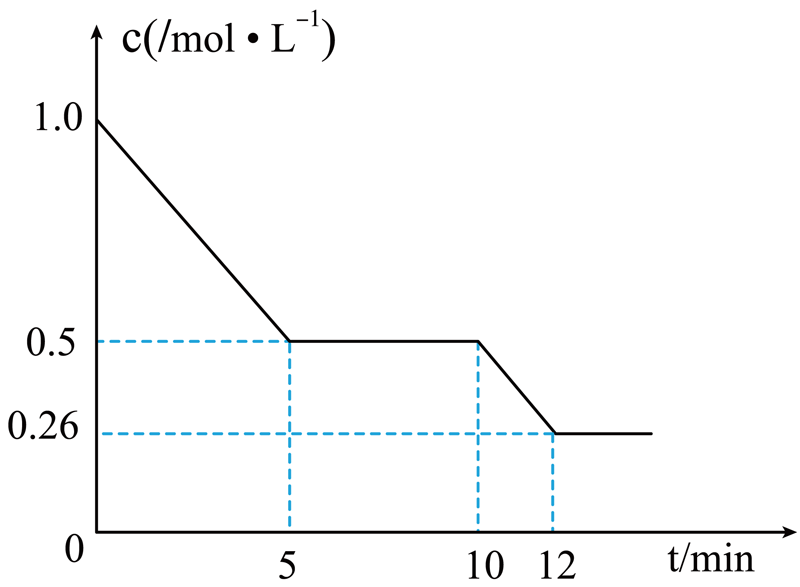 图$\rm 1$
图$\rm 1$
①前$5$分钟内,${v}\left( {{\text{H}}_{2}} \right)=$ $\mathrm{mol} /(\mathrm{L} \cdot \mathrm{min})$。
②$10\;\rm \min $时,改变的外界条件可能是 。
③${{{T}}_{1}}$下,在$\text{1\;\rm L}$恒容密闭容器中充入$2\ \text{mol\ CO}2\;\rm \text{mol}{{\text{H}}_{2}}$和$3\ \text{mol\ C}{{\text{H}}_{3}}\text{OH}(\text{g})$,此时反应将 $\rm ($填“向左进行”“向右进行”“达到平衡”或“无法判断”$\rm )$。
$\\rm 0.2$; 降低温度; 向右进行
"]]①前$5$分钟内,$\rm CO$浓度变化量为$\text{1}{.0\;\rm mol/L-0}{.5\;\rm mol/L=0}{.5\;\rm mol/L}$,根据化学计量数之比,${v(}{{\text{H}}_{\text{2}}}{)=2v{(\rm CO)}=2}\times \dfrac{{0}{.5\;\rm mol/L}}{{5\;\rm min}}{=0}{.2\;\rm mol/(L}\cdot \text{min)}$,$ {K=}\dfrac{{c(\rm C}{{\text{H}}_{\text{3}}}\text{OH)}}{{c(\rm CO)}\times {{{c}}^{\text{2}}}\text{(}{{\text{H}}_{\text{2}}}\text{)}}=\dfrac{{0}{.5}}{\text{0}{.5}\times {{\text{1}}^{\text{2}}}}\text{=1}$;
②反应$\text{CO(g)+2}{{\text{H}}_{\text{2}}}\text{(g)}\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)}\quad \Delta{ H\lt 0}$,由图像可知平衡时${c(\rm CO)=0}{.26\;\rm mol/L}$,起始充入$\text{2\;\rm mol}\ \text{CO}$和$\text{4\;\rm mol}\ {{\text{H}}_{\text{2}}}$,容器体积$\rm 2\;\rm L$,列三段式求出平衡时${c(}{{\text{H}}_{\text{2}}}{)=0}{.52\;\rm mol/L}$,${c(\text C}{{\text{H}}_{\text{3}}}\text{OH)=0}{.74\;\rm mol/L}$,平衡常数${K=}\dfrac{{c(\text C}{{\text{H}}_{\text{3}}}\text{OH)}}{{c(\rm CO)}\times {{{c}}^{\text{2}}}{(}{{\text{H}}_{\text{2}}}{)}}=\dfrac{{0}{.74}}{{0}{.26}\times \text{0}\text{.5}{{\text{2}}^{\text{2}}}}\approx \text{10}{.5}$,平衡常数变大,则$\rm 10$ $\rm min$时平衡正向移动,改变的外界条件可能是降低温度;
③${{{T}}_{\text{1}}}{}^\circ \text{C}$时,在$\rm 1\;\rm L$恒容密闭容器中充入$\text{2\;\rm mol}\ \text{CO}$、$\text{2\;\rm mol}\ {{\text{H}}_{\text{2}}}$和$\text{3\;\rm mol}\ \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)}$,此时浓度商${{{Q}}_{\text{c}}}=\dfrac{\text{3}}{\text{2}\times {{\text{2}}^{\text{2}}}}\text{=0}{.3751}$,所以反应向右进行。
$\rm I$$\rm I$.一种高性能的碱性硼化钒空气电池如图$\rm 2$所示,其中在$\text{V}{{\text{B}}_{\text{2}}}$电极上发生反应:$\text{V}{{\text{B}}_{2}}+16\text{O}{{\text{H}}^{-}}-11{{\text{e}}^{-}}=\text{VO}_{4}^{3-}+2\text{B}(\text{OH})_{4}^{-}+4{{\text{H}}_{2}}\text{O}$。
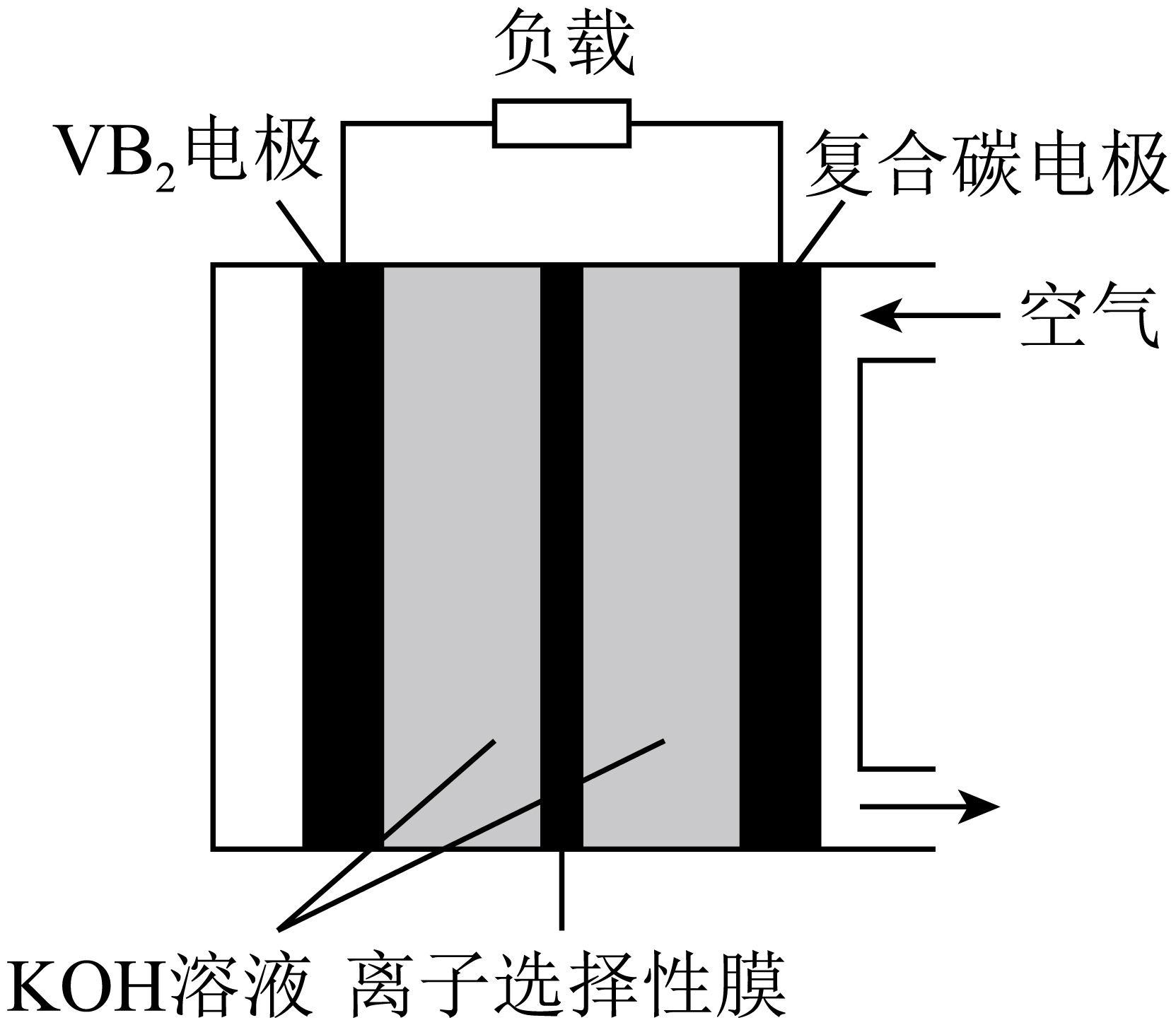 图$\rm 2$
图$\rm 2$
该电池工作时,正极区的$\text{pH}$值 $\rm ($填“变大”、“变小”或“不变”$\rm )$。使用该电池作为直流电源,用惰性电极电解$250\ \text{ml\ 0}.{2\;\rm mol/L\ CuS}{{\text{O}}_{4}}$溶液,当溶液的质量减轻$\text{7}{.6\;\rm g}$,电解过程中转移电子的物质的量是 $\;\rm \text{mol}$。
变大; $\\rm 0.5$
"]]①在碱性硼化钒 $\rm -$ 空气电池中,$\text{V}{{\text{B}}_{\text{2}}}$电极发生失电子的氧化反应,为负极;正极上是氧气得电子发生还原反应,电极反应式为${{\text{O}}_{\text{2}}}\text{+4}{{\text{e}}^{-}}\text{+2}{{\text{H}}_{\text{2}}}\text{O=4O}{{\text{H}}^{-}}$。由于正极生成了$\text{O}{{\text{H}}^{-}}$,所以正极区的${c(\rm O}{{\text{H}}^{-}}\text{)}$增大,$\rm pH$值变大;
②用惰性电极电解$\text{CuS}{{\text{O}}_{\text{4}}}$溶液,总反应为$\text{2CuS}\text{O}_{\text{4}}\text{+2}\text{H}_{\text{2}}\text{O}\begin{array}{c}\underline{\underline{电解}}\\{}\end{array}\text{2Cu+}\text{O}_{\text{2}}\uparrow\text{+2}\text{H}_{\text{2}}\text{S}\text{O}_{\text{4}}$。每转移$\rm 4\;\rm mol$电子,溶液减少的质量为$\text{2\;\rm mol\;\rm Cu}$和$\text{1\;\rm mol}\ {{\text{O}}_{\text{2}}}$的质量之和,即${2\;\rm mol}\times {64\;\rm g/mol+1\;\rm mol}\times {32\;\rm g/mol=160\;\rm g}$。已知溶液质量减轻$\rm 7.6\;\rm g$ ,设转移电子物质的量为$n$ ,则$\dfrac{{4\;\rm mol}}{\text{160\;\rm g}}=\dfrac{{n}}{{7}{.6\;\rm g}}$,解得$n$ $\rm =$ $\rm 0.4\;\rm mol$;用惰性电极电解$\text{CuS}{{\text{O}}_{\text{4}}}$溶液,总反应为$\text{2CuS}\text{O}_{\text{4}}\text{+2}\text{H}_{\text{2}}\text{O}\begin{array}{c}\underline{\underline{电解}}\\{}\end{array}\text{2Cu+}\text{O}_{\text{2}}\uparrow\text{+2}\text{H}_{\text{2}}\text{S}\text{O}_{\text{4}}$,溶液质量减轻是因为生成了$\rm Cu$和${{\text{O}}_{\text{2}}}$,设生成$\rm Cu$的物质的量为${x\ \rm mol}$,生成${{\text{O}}_{\text{2}}}$的物质的量为${y\rm \ mol}$,根据反应可知,$ n{(\rm Cu)}:n({{\text{O}}_{\text{2}}}\rm )$ $\rm =$ $\rm 2:1$,且溶液减轻的质量为$64x$ $\rm +$ $ 32y$,已知$ n(\text{CuS}{{\text{O}}_{{4}}}\rm )={0}{.25\;\rm L}\times \text{0}{.2\;\rm mol/L=0}{.05\;\rm mol}$,若$\text{CuS}{{\text{O}}_{\text{4}}}$完全反应,生成$\rm Cu$的物质的量为$\rm 0.05\;\rm mol$,生成${{\text{O}}_{\text{2}}}$的物质的量为$\rm 0.025\;\rm mol$,此时溶液减轻的质量为${0}{.05\;\rm mol}\times {64\;\rm g/mol+0}{.025\;\rm mol}\times {32\;\rm g/mol=3}{.2\;\rm g+0}{.8\;\rm g=4\;\rm g}$,说明$\text{CuS}{{\text{O}}_{\text{4}}}$反应完后水还在继续电解$\text{CuS}{{\text{O}}_{\text{4}}}$反应过程中:
$\text{2CuS}\text{O}_{\text{4}}\text{+2}\text{H}_{\text{2}}\text{O}\begin{array}{c}\underline{\underline{电解}}\\{}\end{array}\text{2Cu+}\text{O}_{\text{2}}\uparrow\text{+2}\text{H}_{\text{2}}\text{S}\text{O}_{\text{4}}$,此过程溶液减轻质量为${0}{.05\;\rm mol}\times {64\;\rm g/mol+0}{.025\;\rm mol}\times {32\;\rm g/mol=4\;\rm g}$,水继续电解的质量为$\rm 7.6\;\rm g$ $\rm -$ $\rm 4\;\rm g$ $\rm =$ $\rm 3.6\;\rm g$,$\text{2}\text{H}_{\text{2}}\text{O}\begin{array}{c}\underline{\underline{电解}}\\{}\end{array}\text{2}\text{H}_{\text{2}}\uparrow+\text{O}_{\text{2}}\uparrow$,$ {n(}{{\text{H}}_{\text{2}}}\text{O)=}\dfrac{\text{3}{.6\;\rm g}}{\text{18\;\rm g/mol}}\text{=0}{.2\;\rm mol}$,根据反应可知电解水转移电子的物质的量为$\text{0}{.2\;\rm mol}\times \text{2=0}{.4\;\rm mol}$,电解$\text{CuS}{{\text{O}}_{\text{4}}}$溶液转移电子的物质的量为$\text{0}{.05\;\rm mol}\times {2=0}{.1\;\rm mol}$,所以整个电解过程中转移电子的物质的量是$\rm 0.1\;\rm mol+0.4\;\rm mol$ $\rm =$ $\rm 0.5\;\rm mol$。
高中 | 化学平衡常数题目答案及解析(完整版)
