高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
金属$\rm Ru$被广泛用于制笔行业。某实验小组以某钌废料$\rm [$主要成分是$\rm Ru(CO_{3})_{2}$,含$\rm RuO_{4}($其中$\rm Ru$为$\rm +6$价$\rm )$、$\rm FeO$、$\rm MgO$、$\rm CaO$和$\rm SiO_{2}$等$\rm ]$为原料制备$\rm Ru$的流程如下:
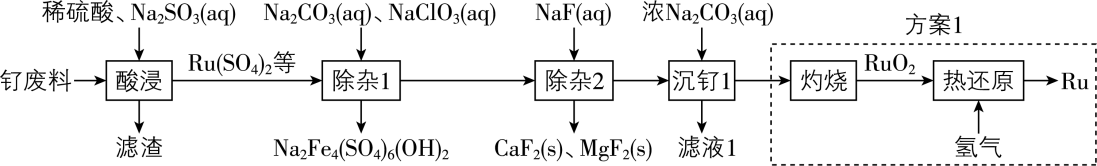
已知:常温下$K\rm _{sp}(CaF_{2})=1.5\times 10^{-10}$,$ K\rm _{sp}(MgF_{2})=7.4\times 10^{-11}$;离子浓度小于或等于$\rm 1\times 10^{-5}\;\rm mol·L^{-1}$时认为该离子已被完全除去。
滤渣的主要成分是 $\rm ($填化学式$\rm )$。
$\\rm SiO_{2}$、$\\rm CaSO_{4}$
"]]由分析可知,滤渣主要成分是二氧化硅和硫酸钙;
“酸浸”中$\rm RuO_{4}$转化为$\rm Ru(SO_{4})_{2}$的离子方程式为 。
$\\text{Ru}{{\\text{O}}_{\\text{4}}}\\text{+2SO}_{\\text{3}}^{\\text{2-}}\\text{+4}{{\\text{H}}^{+}}\\text{=R}{{\\text{u}}^{\\text{4+}}}\\text{+2SO}_{\\text{3}}^{\\text{2-}}\\text{+2}{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]“酸浸”中$\rm RuO_{4}$和硫酸反应生成$\rm Ru(SO_{4})_{2}$和水,离子方程式为$\text{Ru}\text{O}_{\text{4}}\text{+2SO}_{\text{3}}^{\text{2-}}\text{+4}\text{H}^{+}\text{=R}\text{u}^{\text{4+}}\text{+2SO}_{\text{4}}^{\text{2-}}\text{+2}\text{H}_{\text{2}}\text{O}$;
“除杂$\rm 1$”中氯元素被还原成最低价态。若只氧化$\rm Fe^{2+}$,生成$\rm 3$ $\rm mol$ $\rm Na_{2}Fe_{4}(SO_{4})_{6}(OH)_{2}$理论上需要 $\rm \;\rm mol$ $\rm NaClO_{3}$。
$\\rm 2$
"]]加入氯酸钠溶液,将溶液中的亚铁离子转化为$\text{N}{{\text{a}}_{\text{2}}}\text{F}{{\text{e}}_{\text{4}}}{{\left( \text{S}{{\text{O}}_{\text{4}}} \right)}_{\text{6}}}{{\left( \text{OH} \right)}_{\text{2}}}$沉淀,氯化合价由$\rm +5$变为$\rm -1$、铁化合价由$\rm +2$变为$\rm +3$,由电子守恒$\rm 3\text{N}{{\text{a}}_{\text{2}}}\text{F}{{\text{e}}_{\text{4}}}{{\left( \text{S}{{\text{O}}_{\text{4}}} \right)}_{\text{6}}}{{\left( \text{OH} \right)}_{\text{2}}}\sim \text{12}{{\text{e}}^{-}}\sim 2\text{NaCl}{{\text{O}}_{\text{3}}}$,则生成$\rm 3$ $\rm mol$ $\rm Na_{2}Fe_{4}(SO_{4})_{6}(OH)_{2}$理论上需要$\rm 2\;\rm mol$ $\rm NaClO_{3}$。
“除杂$\rm 1$”之后,若滤液中${c\rm (Mg^{2+})}=c\rm (Ca^{2+})$,则“除杂$\rm 2$”中先生成的沉淀是 。“除杂$\rm 2$”后的滤液中$ c\rm (F^{-})=0.01$ $\rm mol·L^{-1}$,则$\rm Ca^{2+}$和$\rm Mg^{2+}$是否除尽? $\rm ($填“是”或“否”$\rm )$。
$\\rm MgF_{2}$;是
"]]由溶度积可知,向镁离子和钙离子浓度相等的溶液中加入氟化钠溶液,溶度积小的氟化镁优先沉淀;由滤液中的氟离子浓度为$\rm 0.01\;\rm mol/L$可知,溶液中钙离子、镁离子浓度分别为$\dfrac{1.5\times {{10}^{-10}}}{{{0.01}^{\text{2}}}}\text{=1}\text{.5}\times \text{1}{{\text{0}}^{\text{-6}}}\text{ mol/L}$、$\dfrac{7.4\times {{10}^{-11}}}{{{0.01}^{\text{2}}}}=7.4\times {{10}^{-7}}\text{ mol/L}$,离子浓度均小于$\rm 1\times 10^{-5}\;\rm mol/L$,所以溶液中的钙离子、镁离子均完全沉淀;
“除杂$\rm 2$”宜选择的容器材质有$(\quad\ \ \ \ )\rm ($填序号$\rm )$。
陶瓷
","铁
","石英
"]氟化钠是强碱弱酸盐,氟离子在溶液中水解生成的氢氟酸能与二氧化硅反应,所以“除杂$\rm 2$”宜选择的容器为铁质容器,不能选择陶瓷和石英容器,故选:$\rm B$;
为优化方案$\rm 1$,该小组设计出方案$\rm 2$如下,从安全角度分析,方案$\rm 2$优于方案$\rm 1$的理由是 。
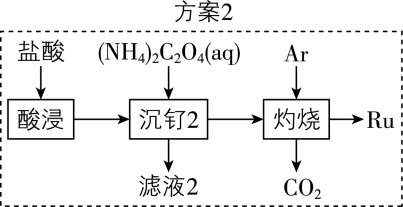
方案$\\rm 1$使用氢气作还原剂,氢气是易燃易爆气体,而方案$\\rm 2$利用草酸根离子的还原性还原钌,更安全
"]]方案$\rm 1$使用氢气作还原剂,氢气是易燃易爆气体,而方案$\rm 2$利用草酸根离子的还原性还原钌,更安全,故方案$\rm 2$优于方案$\rm 1$;
$\rm CaF_{2}$晶胞如图所示,$\rm Ca^{2+}$将晶胞切割成$\rm 8$个小空隙,$\rm F^{-}$填充在$\rm Ca^{2+}$构成的 $\rm ($填“正八面体”“正方体”或“正四面体”$\rm )$空隙中,其填充率为 $\rm ($填充率$\rm =\dfrac{{{\text{F}}^{-}占据空隙数}}{空隙总数}\rm \times 100\%)$。
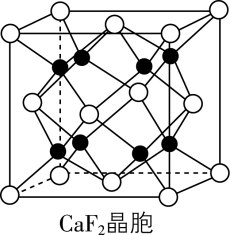
正四面体;$\\rm 100\\%$
"]]由晶胞结构可知,晶胞中位于顶点和面心钙离子将晶胞切割成$\rm 8$个小立方体,$\rm 8$个氟离子位于每个小立方体的体心,所以氟离子的填充率为$\rm 100\%$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
