高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
氮的化合物对人类生产、生活有着重要的作用。
$\rm I$.$\rm NCl_{3}$是一种黄色油状液体,可用于漂白和杀菌。已知:$\rm NCl_{3}$熔点为$\rm -40\;\rm ^\circ\rm C$,沸点为$\rm 70\;\rm ^\circ\rm C$,$\rm 95\;\rm ^\circ\rm C$以上易爆炸,遇碱则迅速反应。在实验室可用$\rm Cl_{2}$和$\rm NH_{4}Cl$溶液反应制取$\rm NCl_{3}$,所用仪器如图甲所示$\rm ($忽略部分夹持装置$\rm )$:
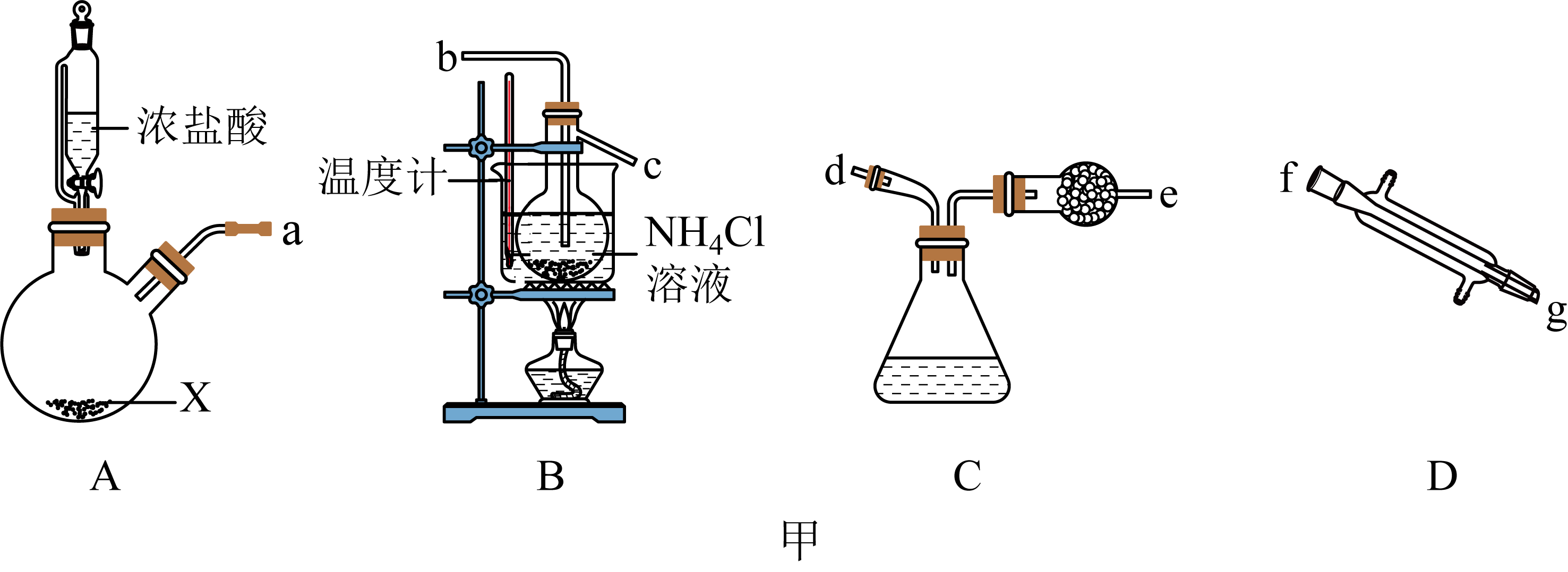
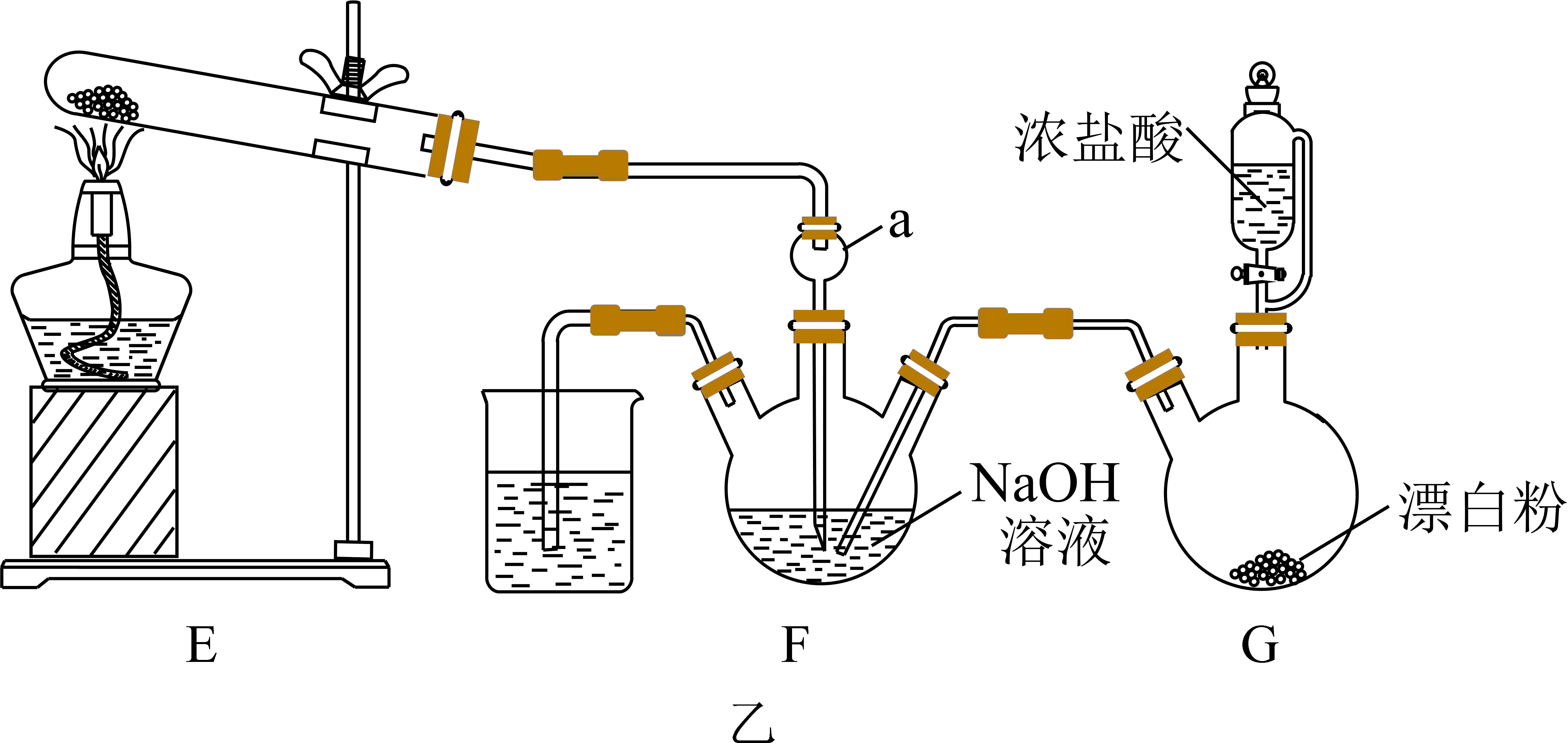
Ⅱ$\rm .$肼$\rm (N_{2}H_{4})$是一种重要的工业产品,实验室用$\rm NH_{3}$与$\rm Cl_{2}$合成$\rm (N_{2}H_{4})$并探究肼的性质。实验装置如图乙所示:
回答下列问题:
$\rm NCl_{3}$分子的空间结构为 。
三角锥形
"]]$\rm NCl_{3}$中$\rm N$的价层电子对数$\rm =3+\dfrac{5-3\times 1}{2}\rm =4$,为$\rm sp^{3}$杂化,空间构型为三角锥形;
图$\rm A$和图$\rm G$中盛装浓盐酸的仪器名称为 ;若药品$\rm X$为氯酸钾;则$\rm A$中反应的离子方程式为 ;根据气流方向,各仪器的连接顺序为 $\rm ($用各接口字母表示,各接口所需橡胶塞已省略$\rm )$。
恒压滴液漏斗;$\\rm ClO_{3}^{-}\\rm +5Cl^{-}+6H^{+}=3C1_{2}↑+3H_{2}O$;$\\rm a→b→c→f→g→d→e$
"]]根据仪器的构造可知,图$\rm A$和图$\rm G$中盛装浓盐酸的仪器名称为恒压滴液漏斗;若药品$\rm X$为氯酸钾;则$\rm A$中氯酸钾与盐酸反应生成氯气,反应的离子方程式为$\rm ClO_{3}^{-}\rm +5Cl^{-}+6H^{+}=3C1_{2}↑+3H_{2}O$;
利用装置$\rm A$制取氯气,利用装置$\rm B$制取$\rm NCl_{3}$,利用装置$\rm D$冷凝$\rm NCl_{3}$,用装置$\rm C$收集$\rm NCl_{3}$,故正确连接顺序为$\rm a→b→c→f→g→d→e$;
$\rm N_{2}H_{4}$的制备实验中,装置存在一处缺陷会使$\rm N_{2}H_{4}$产率降低,请提出改进方法 。
$\\rm F$、$\\rm G$之间增加盛有饱和食盐水的装置
"]]$\rm Cl_{2}$中含有挥发产生的$\rm HCl$,会和装置$\rm F$中氢氧化钠溶液反应,导致册的产率降低,改进方法是在装置$\rm F$、$\rm G$之间加盛装有饱和食盐水的洗气瓶,除去氯化氢气体;
探究$\rm N_{2}H_{4}$的性质:取装置$\rm F$中溶液,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到无色晶体。经分析知该晶体为$\rm N_{2}H_{6}SO_{4}$和$\rm (N_{2}H_{5})_{2}SO_{4}$,可推出$\rm N_{2}H_{4}·H_{2}O$呈 $\rm ($填“酸性”或“碱性”$\rm )$,其主要电离方程式为 。
碱性;$\\rm N_{2}H_{4}·H_{2}O\\rightleftharpoons {{\\text{N}}_{\\text{2}}}\\text{H}_{5}^{+}\\rm +OH^{-}$
"]]肼是二元弱碱,与强酸反应,可产生正盐和碱式盐,$\rm N_{2}H_{4}·H_{2}O$呈碱性;其主要电离方程式为$\rm N_{2}H_{4}·H_{2}O\rightleftharpoons {{\text{N}}_{\text{2}}}\text{H}_{5}^{+}\rm +OH^{-}$;
测定$\rm NCl_{3}($摩尔质量为$\rm 120.5\;\rm g·mol^{-1})$的纯度:已知$\rm NCl_{3}$的制取是可逆反应,根据反应$\rm NCl_{3}+4HCl=NH_{4}Cl+3Cl_{2}↑$,利用间接碘量法测定氯气的量即可测定$\rm NCl_{3}$的纯度。
实验步骤:
ⅰ$\rm .$准确称量$\rm C$中的产物$\rm 1.00\;\rm g$置于三颈烧瓶中,加入足量浓盐酸,使用磁力搅拌器搅拌,并鼓入氮气;
ⅱ$\rm .$将混合气通入$\rm 300\;\rm mL\;\rm 0.10\;\rm mol/L\;KI$溶液中,待试管中无色液体变成黄色且颜色不再变化,关闭氮气$\rm ($溶液体积变化忽略不计$\rm )$;
ⅲ$\rm .$量取$\rm 30.00\;\rm mL$吸收液,加入淀粉指示剂,用$\rm 0.15\;\rm mol/L\;Na_{2}S_{2}O_{3}$标准液进行滴定,滴定至终点时消耗$\rm Na_{2}S_{2}O_{3}$溶液$\rm 20.00\;\rm mL$。$\rm ($已知:反应原理为$\rm I_{2}+2Na_{2}S_{2}O_{3}=Na_{2}S_{4}O_{6}+2NaI)$则$\rm NCl_{3}$的纯度为 。$\rm ($保留三位有效数字$\rm )$
$\\rm 60.3\\%$
"]]$\rm NCl_{3}+4HCl=NH_{4}Cl+3Cl_{2}↑$、$\rm Cl_{2}+2KI=2KCl+I_{2}$、$\rm I_{2}+2Na_{2}S_{2}O_{3}=Na_{2}S_{4}O_{6}+2NaI$,可得$\rm NCl_{3}\sim 3I_{2}\sim 6Na_{2}S_{2}O_{3}$,${n\rm (NCl)}=\dfrac{\text{1}}{\text{6}} n\rm (Na_{2}S_{2}O_{3})=\dfrac{\text{0}\text{.15}\times \text{20}\times \text{1}{{\text{0}}^{\text{-3}}}}{\text{6}}\;mol\times \dfrac{\text{300\;\rm mL}}{\text{30\;\rm mL}}\rm =5\times 10^{-3}\;\rm mol$,故$ m\rm (NCl_{3})=5\times 10^{-3}\;\rm mol\times 120.5\;\rm g/mol=0.6025\;\rm g$,其纯度为$\dfrac{\text{0}\text{.6025}}{\text{1}\text{.00}}\rm \times 100\%=60.3\%$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
