高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
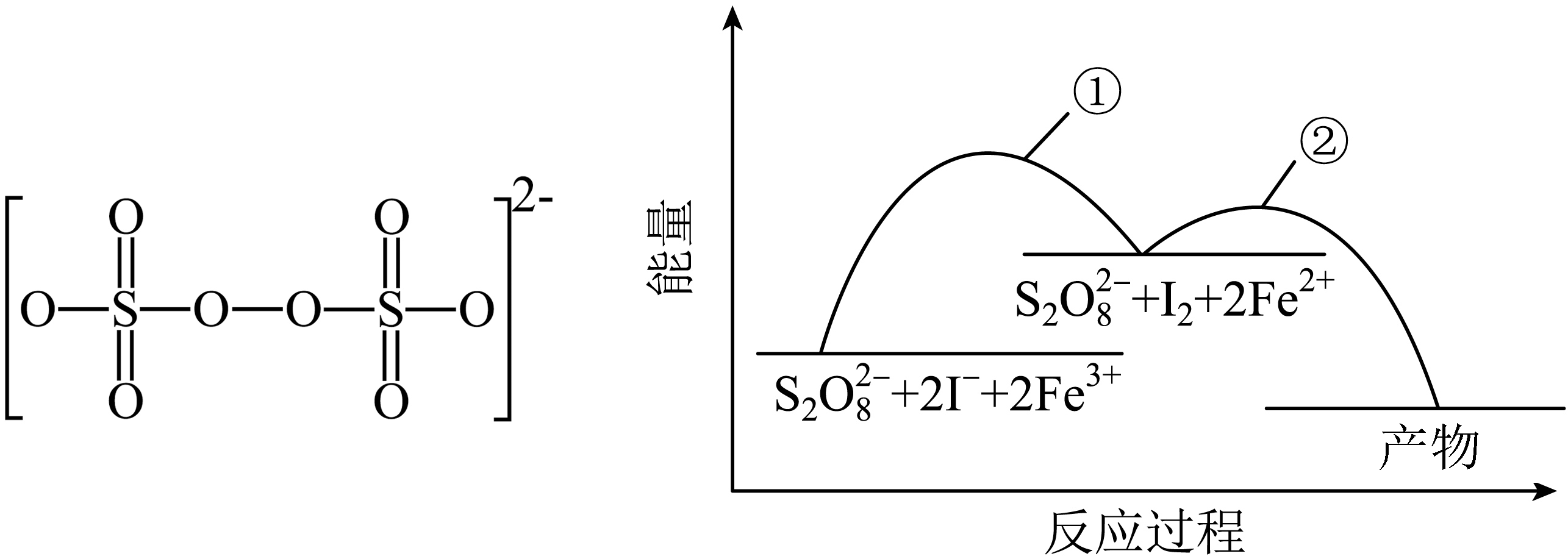
过二硫酸钾不稳定,加热时分解,溶于水会发生一定程度的水解。水溶液中,过二硫酸盐与碘离子反应的离子方程式为:$\rm {{S}_{2}}O_{8}^{2-}+2{{I}^{-}}\rightleftharpoons 2SO_{4}^{2-}+{{I}_{2}}$,向溶液中加入含$\rm F{{e}^{3+}}$的溶液,反应机理如图所示。
$\rm {{K}_{2}}{{S}_{2}}{{O}_{8}}$中$\rm S$元素的化合价为 价。
$\\rm +6$
"]]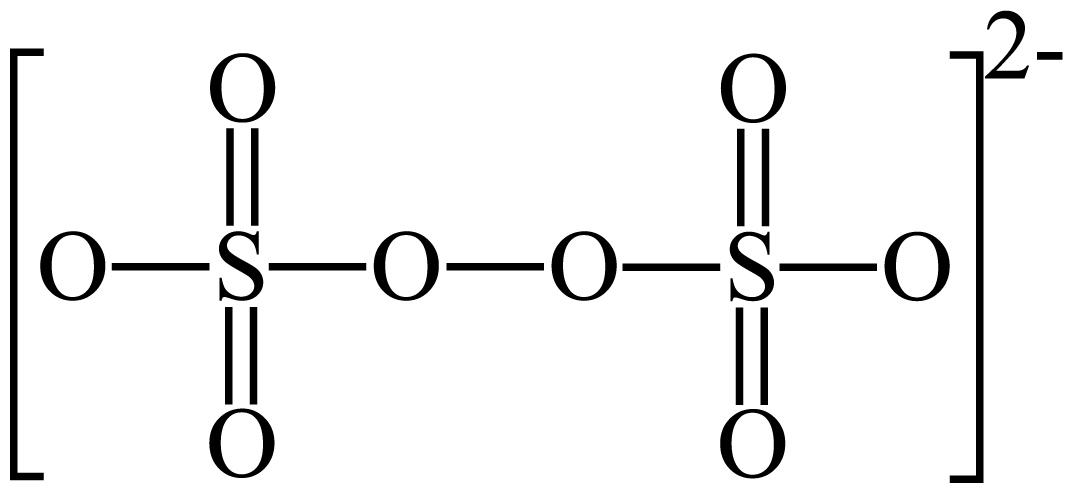 带$\rm 2$个单位负电荷,且结构中存在$\rm 1$个过氧根,其中氧的负价总和为$\rm -14$,结构中存在$\rm 2$个$\rm S$,则$\rm S$元素的化合价为$\rm +6$。
带$\rm 2$个单位负电荷,且结构中存在$\rm 1$个过氧根,其中氧的负价总和为$\rm -14$,结构中存在$\rm 2$个$\rm S$,则$\rm S$元素的化合价为$\rm +6$。
$\rm K$基态原子最外层电子排布式 ,$\rm K$基态原子核外电子有 种空间运动状态。与$\rm K$同周期,基态原子有$\rm 4$个未成对电子的元素有 种。
$\\rm 4{{s}^{1}}$;$\\rm 10$;$\\rm 1$
"]]$\rm K$为$\rm 19$号元素,基态$\rm K$原子最外层电子排布式$\rm 4{{s}^{1}}$;电子在原子核外的一个空间运动状态称为一个原子轨道,因而空间运动状态个数等于轨道数,$\rm K$基态原子核外电子排布为$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}4s^{1}$,有$\rm 10$种空间运动状态,与$\rm K$同周期,基态原子有$\rm 4$个未成对电子的元素为$\rm 26$号$\rm Fe$:$\rm 1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{6}4s^{2}$,故有$\rm 1$种。
$\rm {{S}_{2}}O_{8}^{2-}$结构中键角$\rm ∠OSO$ $\rm ∠SOO($填“$\rm \gt $”或“$\rm =$”或“$\rm \lt $”$\rm )$。
$\\rm \\gt $
"]]$\rm {{S}_{2}}O_{8}^{2-}$结构中$\rm S$为$\rm sp^{3}$杂化且无孤电子对,中间$\rm O$为$\rm sp^{3}$杂化且存在$\rm 2$对孤电子对,孤电子对与成键电子对之间的斥力大于成键电子对之间的斥力,导致键角$\rm ∠OSO\gt ∠SOO$。
反应速率① ②$\rm ($填“$\rm \gt $”或“$\rm =$”或“$\rm \lt $”$\rm )$,反应②的离子方程式为 。向反应后的溶液滴加淀粉溶液后再适当升温,现象 。
$\\rm \\lt $;$\\rm 2F{{e}^{2+}}+{{S}_{2}}O_{8}^{2-}=2F{{e}^{3+}}+SO_{4}^{2-}$;溶液先变蓝,后蓝色变浅
"]]过渡态物质的总能量与反应物总能量的差值为活化能,活化能越小反应越快,活化能越大反应越慢,由图可知,反应①的活化能较大,则速率①$\rm \lt $②;反应②为亚铁离子被$\rm {{S}_{2}}O_{8}^{2-}$氧化为铁离子,同时生成硫酸根离子,离子方程式为$\rm 2F{{e}^{2+}}+{{S}_{2}}O_{8}^{2-}=2F{{e}^{3+}}+SO_{4}^{2-}$。水溶液中,过二硫酸盐与碘离子反应的离子方程式为:$\rm {{S}_{2}}O_{8}^{2-}+2{{I}^{-}}\rightleftharpoons 2SO_{4}^{2-}+{{I}_{2}}$,反应后生成碘单质,能使淀粉溶液变蓝色,升高温度,过二硫酸钾不稳定分解,导致反应逆向移动,使得碘单质浓度减小,溶液蓝色变浅,故向反应后的溶液滴加淀粉溶液后再适当升温,现象溶液先变蓝,后蓝色变浅。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
