高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
四氧化三锰$\rm (\text{M}{{\text{n}}_{3}}{{\text{O}}_{4}}\rm )$用途广泛,如合成高品质电极材料锰酸锂、制造磁性材料锰锌铁氧体、制备汽车用温度传感器的热敏电阻等。用软锰矿为原料制备$\text{M}{{\text{n}}_{3}}{{\text{O}}_{4}}$的工艺流程如下所示。
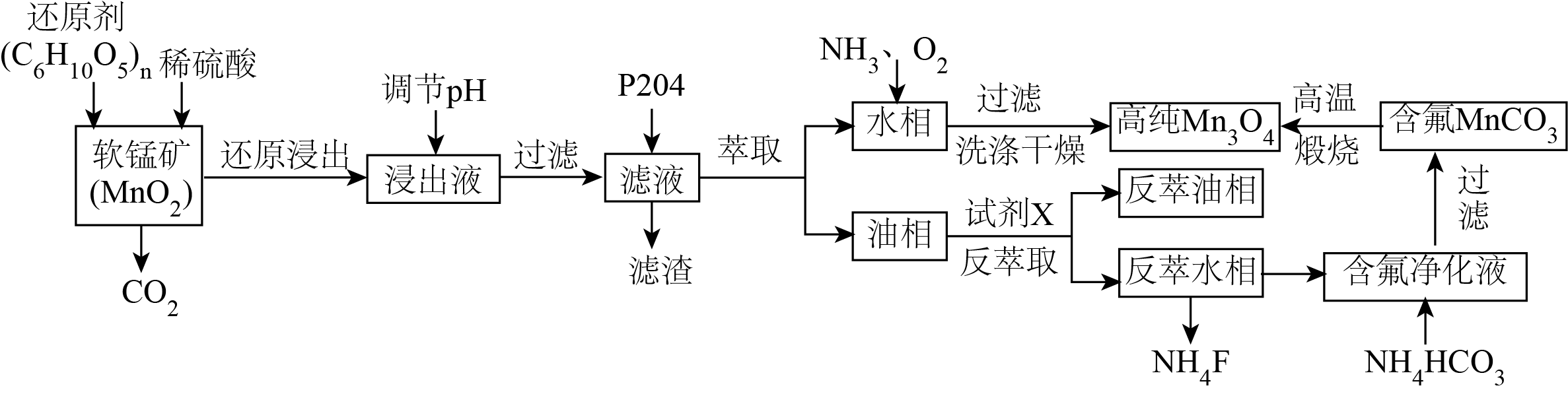
已知:①浸出液$\text{MnS}{{\text{O}}_{4}}$中含$\text{M}{{\text{g}}^{2+}}$、$\text{C}{{\text{a}}^{2+}}$、$\text{F}{{\text{e}}^{3+}}$、$\text{C}{{\text{u}}^{2+}}$等杂质;
②常温时,一些物质的${{K}_{\text{sp}}}$如下表所示。
| 物质 | $\text{Fe}{{\left( \text{OH} \right)}_{3}}$ | $\text{Cu}{{\left( \text{OH} \right)}_{2}}$ | $\text{Mn}{{\left( \text{OH} \right)}_{2}}$ | $\text{Mg}{{\left( \text{OH} \right)}_{2}}$ | $\text{Ca}{{\text{F}}_{2}}$ | $\text{Mg}{{\text{F}}_{2}}$ | $\text{Mn}{{\text{F}}_{2}}$ |
| ${{K}_{\text{sp}}}$ | $2.8\times {{10}^{-39}}$ | $2\times {{10}^{-20}}$ | $4.0\times {{10}^{-14}}$ | $5.1\times {{10}^{-12}}$ | $1.5\times {{10}^{-10}}$ | $5.2\times {{10}^{-11}}$ | $5.0\times {{10}^{-3}}$ |
请回答下列问题:
写出还原浸出中$\text{Mn}{{\text{O}}_{2}}$发生反应的化学反应方程式: 。
$ {12n\\rm Mn}{{\\text{O}}_{\\text{2}}}+{{\\left( {{\\text{C}}_{\\text{6}}}{{\\text{H}}_{\\text{10}}}{{\\text{O}}_{\\text{5}}} \\right)}_{ {n}}} {+12n}{{\\text{H}}_{\\text{2}}}\\text{S}{{\\text{O}}_{\\text{4}}} {=12n\\rm MnS}{{\\text{O}}_{\\text{4}}} {+6n\\rm C}{{\\text{O}}_{\\text{2}}}\\uparrow {+17n}{{\\text{H}}_{\\text{2}}}\\text{O}$
"]]出液中$\text{Mn}$元素的存在形式主要是$\text{MnS}{{\text{O}}_{4}}$,该反应的化学方程式为$ {12n\rm Mn}{{\text{O}}_{\text{2}}}+{{\left( {{\text{C}}_{\text{6}}}{{\text{H}}_{\text{10}}}{{\text{O}}_{\text{5}}} \right)}_{ {n}}} {+12n}{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}} {=12n\rm MnS}{{\text{O}}_{\text{4}}} {+6n\rm C}{{\text{O}}_{\text{2}}}\uparrow {+17n}{{\text{H}}_{\text{2}}}\text{O}$;
调节$\rm pH$时,若使$\text{F}{{\text{e}}^{3+}}$、$\text{C}{{\text{u}}^{2+}}$沉淀完全$\rm ($浓度不大于$1.0\times {{10}^{-5}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\rm )$,$\rm pH$至少为 $\rm ($已知:$\lg 2=0.3\rm )$。
$\\rm 6.65$
"]]$\text{Fe}{{(\text{OH})}_{3}}$的${{K}_{\text{sp}}}=2.8\times {{10}^{-39}}$,若使$\text{F}{{\text{e}}^{3+}}$沉淀完全,$\text{pH}$应在$3\sim 4$之间,$\text{Cu}{{(\text{OH})}_{2}}$的${{K}_{\text{sp}}}=2\times {{10}^{-20}}$,若使$\text{C}{{\text{u}}^{2+}}$沉淀完全,则$c\left( \text{O}{{\text{H}}^{-}} \right)=\sqrt{2\times {{10}^{-15}}}\text{ mol}\cdot {{\text{L}}^{-1}}={{2}^{\tfrac{1}{2}}}\times {{10}^{-7.5}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,$c\left( {{\text{H}}^{+}} \right)={{2}^{-\tfrac{1}{2}}}\times {{10}^{-6.5}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$,$\text{pH}=-\text{lg}\left( {{2}^{-\tfrac{1}{2}}}\times {{10}^{-6.5}} \right)=6.5+\dfrac{1}{2}\text{lg}2=6.65$,此时$\text{F}{{\text{e}}^{3+}}$已沉淀完全,故$\rm pH$至少为$\rm 6.65$;
$\rm P204$是一种有机酸性萃取剂,用$\rm HA$表示,萃取方程可简写为:$n\text{HA}+{{\text{M}}^{n+}}\to {{\text{A}}_{n}}\text{M}+n{{\text{H}}^{+}}$。当其他条件相同时,若按照不同相比$\rm (P204$与滤液体积比$\rm )$,溶液中钙、镁、锰元素萃取率如下表格:
| 相比 | 钙萃取率$\rm /$% | 镁萃取率$\rm /$% | 锰萃取率$\rm /$% |
| $0.4:1$ | $\rm 68.88$ | $\rm 35.19$ | $\rm 3.43$ |
| $0.8:1$ | $\rm 75.60$ | $\rm 58.28$ | $\rm 6.25$ |
| $1.6:1$ | $\rm 83.12$ | $\rm 72.29$ | $\rm 13.03$ |
| $2:1$ | $\rm 93.43$ | $\rm 83.67$ | $\rm 17.40$ |
| $3:1$ | $\rm 99.78$ | $\rm 90.17$ | $\rm 23.97$ |
根据流程及数据,判断萃取时最佳相比是 ;萃取后,水相中通入氨气和氧气发生主要反应的离子方程式为 ;油相中加入的试剂$\rm X$是 进行反萃取;反萃水相灼烧时火焰呈砖红色,请用相关理论解释原因 ;反萃水相中加入$\text{N}{{\text{H}}_{4}}\text{F}$及后续操作的目的 。
$\\rm 3: 1$;$\\rm 6\\text{M}{{\\text{n}}^{2+}}+12\\text{N}{{\\text{H}}_{3}}+6{{\\text{H}}_{2}}\\text{O}+{{\\text{O}}_{2}}=12\\text{NH}_{4}^{+}+2\\text{M}{{\\text{n}}_{3}}{{\\text{O}}_{4}}\\downarrow $;稀硫酸;反萃取时加入硫酸,平衡$\\rm 2\\text{HA}+\\text{CaS}{{\\text{O}}_{4}}\\rightleftharpoons Ca{{\\text{A}}_{2}}+2{{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}$逆向移动,生成的$\\rm CaS{{O}_{4}}$微溶,水相中含有$\\rm C{{a}^{2+}}$;从反萃取水相中沉淀分离出$\\rm \\text{M}{{\\text{g}}^{2+}}$,回收$\\rm \\text{Mn}$元素
"]]根据工业流程,水相最后可以得到高纯$\rm M{{n}_{3}}{{\text{O}}_{4}}$,则对于$\rm Mn$的萃取率要相对较低,而钙和镁的萃取率要相对较高,当相比为$\rm 3:1$时,镁、钙萃取率最高,虽然锰元素萃取率也在升高,但是根据流程中,锰元素还有回收利用的过程,因此应该以提高镁、钙萃取率为主,因此选择相比为$\rm 3:1$;
“萃取”后,水相中主要是硫酸锰,通入$\text{N}{{\text{H}}_{3}}$和${{\text{O}}_{2}}$时,发生反应的离子方程式为$6\text{M}{{\text{n}}^{2+}}+12\text{N}{{\text{H}}_{3}}+6{{\text{H}}_{2}}\text{O}+{{\text{O}}_{2}}=12\text{NH}_{4}^{+}+2\text{M}{{\text{n}}_{3}}{{\text{O}}_{4}}\downarrow $;
“反萃取”时,应使$n\text{HA}+{{\text{M}}^{n+}}\rightleftharpoons \text{M}{{\text{A}}_{n}}+n{{\text{H}}^{+}}$反应逆向移动,可以增加${{\text{H}}^{+}}$的浓度,且不引入其他阴离子,所以应加入的试剂$\rm X$是稀硫酸;
反萃水相灼烧时火焰呈砖红色,说明含有钙元素,原因是反萃取时加入硫酸,平衡$\rm 2\text{HA}+\text{CaS}{{\text{O}}_{4}}\rightleftharpoons Ca{{\text{A}}_{2}}+2{{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$逆向移动,生成的$\rm CaS{{O}_{4}}$微溶,水相中含有$\rm C{{a}^{2+}}$;
根据上述分析可知,反萃取水相中含有$\text{M}{{\text{g}}^{2+}}$和$\text{M}{{\text{n}}^{2+}}$,因此反萃取水相中继续加入$\text{N}{{\text{H}}_{4}}\text{F}$并进行后续操作的目的是从反萃取水相中沉淀分离出$\text{M}{{\text{g}}^{2+}}$,回收$\text{Mn}$元素;
此流程中能循环利用的试剂是 。
$\\rm P204$或反萃取油相
"]]因为油相中加入硫酸反萃取后,得到反萃取油相$\rm P204$即$\rm HA$,因此可以循环利用的是$\rm P204$或反萃取油相。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
