| 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
室温下,向$\rm 10$ $\rm mL$ $0.05\,\text{mol}\cdot {{\text{L}}^{-1}}$的$\rm NaHCO_{3}$溶液中滴加$0.05\,\text{mol}\cdot {{\text{L}}^{-1}}$的盐酸$\rm ($或$0.05\,\text{ mol}\cdot {{\text{L}}^{-1}}$ $\rm NaOH$溶液$\rm )$,溶液的$\rm pH$随加入酸$\rm ($或碱$\rm )$体积的变化如图所示。下列说法正确的是$(\quad\ \ \ \ )$
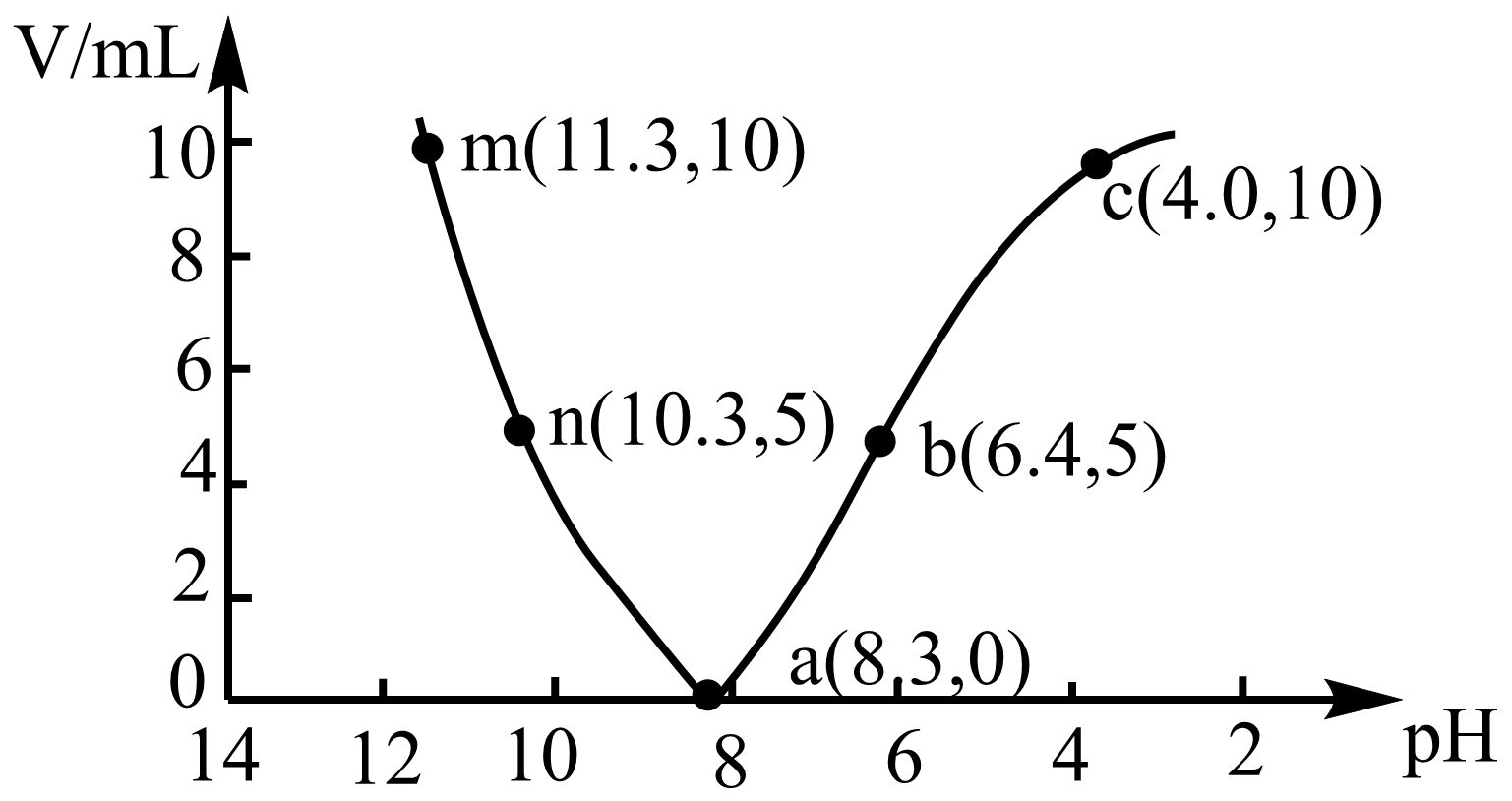
根据题中信息不能判断$\\rm NaHCO_{3}$溶液中$\\text{HCO}_{3}^{-}$的水解程度与电离程度的大小
","$\\rm a→n→m$过程中:$c\\left( \\text{HCO}_{3}^{-} \\right)+2c\\left( \\text{CO}_{3}^{2-} \\right)+c\\left( \\text{O}{{\\text{H}}^{-}} \\right)$逐渐减小
","$\\rm a→b→c$过程中:$c\\left( \\text{N}{{\\text{a}}^{+}} \\right)\\lt c\\left( \\text{HCO}_{3}^{-} \\right)+c\\left( \\text{CO}_{3}^{2-} \\right)+c\\left( {{\\text{H}}_{2}}\\text{C}{{\\text{O}}_{3}} \\right)$
","$\\rm m$点的$\\left[ c\\left( \\text{N}{{\\text{a}}^{+}} \\right)+c\\left( {{\\text{H}}^{+}} \\right) \\right]$小于$\\rm c$点的$\\left[ c\\left( \\text{N}{{\\text{a}}^{+}} \\right)+c\\left( {{\\text{H}}^{+}} \\right) \\right]$
"]$\rm NaHCO_{3}$溶液中加入盐酸,溶液的$\rm pH$减小,加入$\rm NaOH$溶液,溶液的$\rm pH$增大,所以$\rm a→b→c$是滴加盐酸的变化曲线,$\rm a→n→m$是滴加$\rm NaOH$溶液的变化曲线。
$\rm A$.$a$点溶液的$\rm pH\gt 7$,溶液显碱性,说明$\rm NaHCO_{3}$溶液中$\text{HCO}_{3}^{-}$的水解程度大于电离程度,故$\rm A$错误;
$\rm B$.$\rm a→n→m$是滴加$\rm NaOH$溶液的变化曲线,存在电荷守恒:$c\left( \text{HCO}_{\text{3}}^{-} \right)+2c\left( \text{CO}_{\text{3}}^{\text{2-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)=c\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right)$,由于$\rm NaHCO_{3}$溶液和$\rm NaOH$溶液浓度相等,滴加$\rm NaOH$溶液的过程中$c\left( \text{N}{{\text{a}}^{+}} \right)$不变,$c\left( {{\text{H}}^{+}} \right)$减小,$c\left( \text{HCO}_{\text{3}}^{-} \right)+2c\left( \text{CO}_{\text{3}}^{\text{2-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$逐渐减小,故$\rm B$正确;
$\rm C$.$\rm NaHCO_{3}$溶液存在$c\left( \text{N}{{\text{a}}^{+}} \right)=c\left( \text{HCO}_{\text{3}}^{-} \right)+c\left( \text{CO}_{\text{3}}^{\text{2-}} \right)+c\left( {{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}} \right)$,$\rm a→b→c$过程中加入盐酸,生成$\rm NaCl$、$\rm H_{2}CO_{3}$,$\rm c$点时$\rm pH=4.0$,则有二氧化碳气体逸出,可知$c\left( \text{N}{{\text{a}}^{+}} \right)\gt c\left( \text{HCO}_{\text{3}}^{-} \right)+c\left( \text{CO}_{\text{3}}^{\text{2-}} \right)+c\left( {{\text{H}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}} \right)$,故$\rm C$错误;
$\rm D$.$\rm m$点和$\rm c$点分别加入$\rm 10$ $\rm mL$ $\rm NaOH$溶液和$\rm 10$ $\rm mL$盐酸,$\rm c$点$c\left( \text{N}{{\text{a}}^{+}} \right)=0.025\,\text{mol/L}$,$c\left( {{\text{H}}^{+}} \right)={{10}^{-4}}\,\text{mol/L}$,$\rm m$点$c\left( \text{N}{{\text{a}}^{+}} \right)=0.05\,\text{mol/L}$,$c\left( {{\text{H}}^{+}} \right)={{10}^{-11.3}}\,\text{mol/L}$,则$\rm m$点的$\left[ c\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right) \right]$大于$\rm c$点的$\left[ c\left( \text{N}{{\text{a}}^{+}} \right)+c\left( {{\text{H}}^{+}} \right) \right]$,故$\rm D$错误;
故选:$\rm B$
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
