| 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
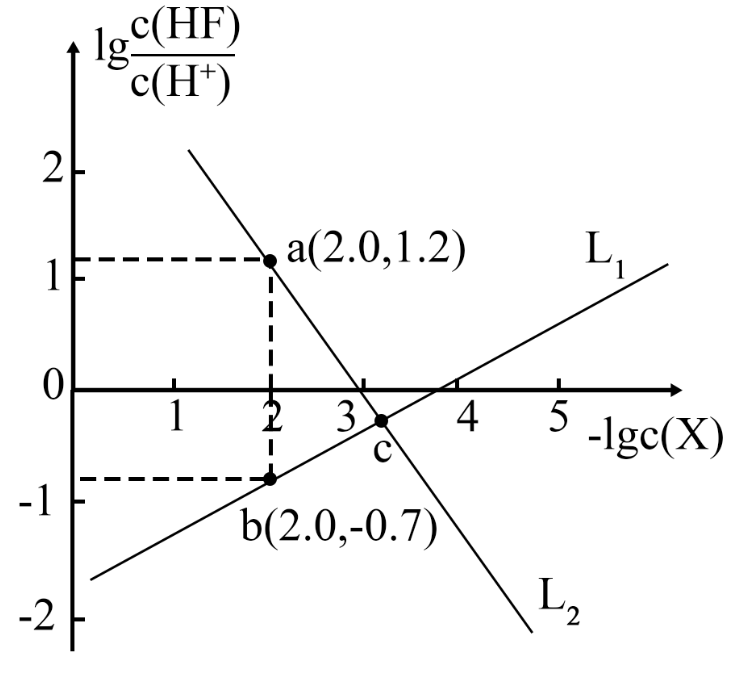
已知$\rm CaF_{2}$是难溶于水、可溶于酸的盐。常温下,用盐酸调节$\rm CaF_{2}$浊液的$\rm pH$,测得在不同$\rm pH$条件下,体系中$\text{lg}\dfrac{c\text{(HF)}}{c\text{(}{{\text{H}}^{+}}\text{)}}$与$-\text{lg}c\left( \text{X} \right)\rm (X$为$\rm Ca^{2+}$或$\rm F^{-}$ $\rm )$的关系如图所示。
下列说法错误的是$(\quad\ \ \ \ )$
$\\rm L_{1}$表示$-\\text{lg}c\\left( {{\\text{F}}^{-}} \\right)$与$\\text{lg}\\dfrac{c\\text{(HF)}}{c\\text{(}{{\\text{H}}^{+}}\\text{)}}$的变化曲线
","${{K}_{\\text{sp}}}\\left( \\text{Ca}{{\\text{F}}_{\\text{2}}} \\right)$的数量级为$\\rm 10^{-10}$
","$\\rm c$点的溶液中:$ c\\left( \\text{C}{{\\text{l}}^{-}} \\right)\\lt c\\left( \\text{C}{{\\text{a}}^{2+}} \\right)$
","$\\rm a$、$\\rm b$、$\\rm c$三点的溶液中: $2c\\left( \\text{C}{{\\text{a}}^{2+}} \\right)=c\\left( {{\\text{F}}^{-}} \\right)+c\\left( \\text{HF} \\right)$
"]已知$\rm HF$的${{K}_{\text{a}}}=\dfrac{c\text{(}{{\text{H}}^{+}}\text{)}c\text{(}{{\text{F}}^{-}}\text{)}}{c\text{(HF)}}$,则有$\dfrac{c\text{(HF)}}{c\text{(}{{\text{H}}^{+}}\text{)}}=\dfrac{c\text{(}{{\text{F}}^{-}}\text{)}}{{{K}_{\text{a}}}}$,即有${\rm lg}\dfrac{c\text{(HF)}}{c\text{(}{{\text{H}}^{+}}\text{)}}$越大,$c\left( {{\text{F}}^{-}} \right)$越大,$\text{lg}c\left( {{\text{F}}^{-}} \right)$越大,$-\text{lg}c\left( {{\text{F}}^{-}} \right)$越小,$c\left( {{\text{F}}^{-}} \right)$越大,$c\left( \text{C}{{\text{a}}^{2+}} \right)$越小,则$-\text{lg}c\left( \text{C}{{\text{a}}^{2+}} \right)$越大,故可知$\rm L_{1}$代表$-\text{lg}c\left( \text{C}{{\text{a}}^{2+}} \right)$的变化曲线,$\rm L_{2}$代表$-\text{lg}c\left( {{\text{F}}^{-}} \right)$的变化曲线,据此分析解题。
$\rm A$.由分析可知,$\rm L_{1}$表示$-\text{lg}c\left( \text{C}{{\text{a}}^{2+}} \right)$与$\text{lg}\dfrac{c\text{(HF)}}{c\text{(}{{\text{H}}^{+}}\text{)}}\rm .$的变化曲线,$\rm A$错误;
$\rm B$.由$\rm a$点坐标可知,$\dfrac{c\text{(HF)}}{c\text{(}{{\text{H}}^{+}}\text{)}}=\dfrac{c\text{(}{{\text{F}}^{-}}\text{)}}{{{K}_{\text{a}}}}\rm =10^{-1.2}$,$c\left( {{\text{F}}^{-}} \right)={{10}^{-2}}$,则${{K}_{\text{a}}}={{10}^{-1.2}}\times {{10}^{-2}}={{10}^{-3.2}}$,由$\rm b$点坐标可知,$c\left( \text{C}{{\text{a}}^{2+}} \right)={{10}^{-2}}\text{ mol/L}$,此时$\dfrac{c\text{(HF)}}{c\text{(}{{\text{H}}^{+}}\text{)}}\rm =10^{-0.7}$,故可求出此时溶液中$c\left( {{\text{F}}^{-}} \right)={{10}^{-0.7}}\times {{10}^{-3.2}}={{10}^{-3.9}}$,故${{K}_{\text{sp}}}\left( \text{Ca}{{\text{F}}_{\text{2}}} \right)=c\left( \text{C}{{\text{a}}^{2+}} \right){{c}^{2}}\left( {{\text{F}}^{-}} \right)={{10}^{-2}}\times {{\left( {{10}^{-3.9}} \right)}^{2}}={{10}^{-9.8}}$,故其数量级为$\rm 10^{-10}$,$\rm B$正确;
$\rm C$.由图象可知,$\rm c$点的溶液中有:$c\left( \text{C}{{\text{a}}^{\text{2+}}} \right)=c\left( {{\text{F}}^{-}} \right)$,结合电荷守恒$2c\left( \text{C}{{\text{a}}^{2+}} \right)+c\left( {{\text{H}}^{+}} \right)=c\left( {{\text{F}}^{-}} \right)+c\left( \text{C}{{\text{l}}^{-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,即有:$c\left( \text{C}{{\text{a}}^{2+}} \right)+c\left( {{\text{H}}^{+}} \right)=c\left( \text{C}{{\text{l}}^{-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,此时${\rm lg}\dfrac{c\text{(HF)}}{c\text{(}{{\text{H}}^{+}}\text{)}}$小于$\rm 0$,即$c\left( \text{HF} \right)\lt c\left( {{\text{H}}^{+}} \right)$,溶液显酸性即$c\left( {{\text{H}}^{+}} \right)\gt c\left( \text{O}{{\text{H}}^{-}} \right)$,故有 $c\left( \text{C}{{\text{l}}^{-}} \right)\gt c\left( \text{C}{{\text{a}}^{\text{2+}}} \right)$,$\rm C$错误;
$\rm D$.根据物料守恒可知,$\rm a$、$\rm b$、$\rm c$三点的溶液中: $2c\left( \text{C}{{\text{a}}^{\text{2+}}} \right)=c\left( {{\text{F}}^{-}} \right)+c\left( \text{HF} \right)$,$\rm D$正确;
故选:$\rm AC$
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
