| 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
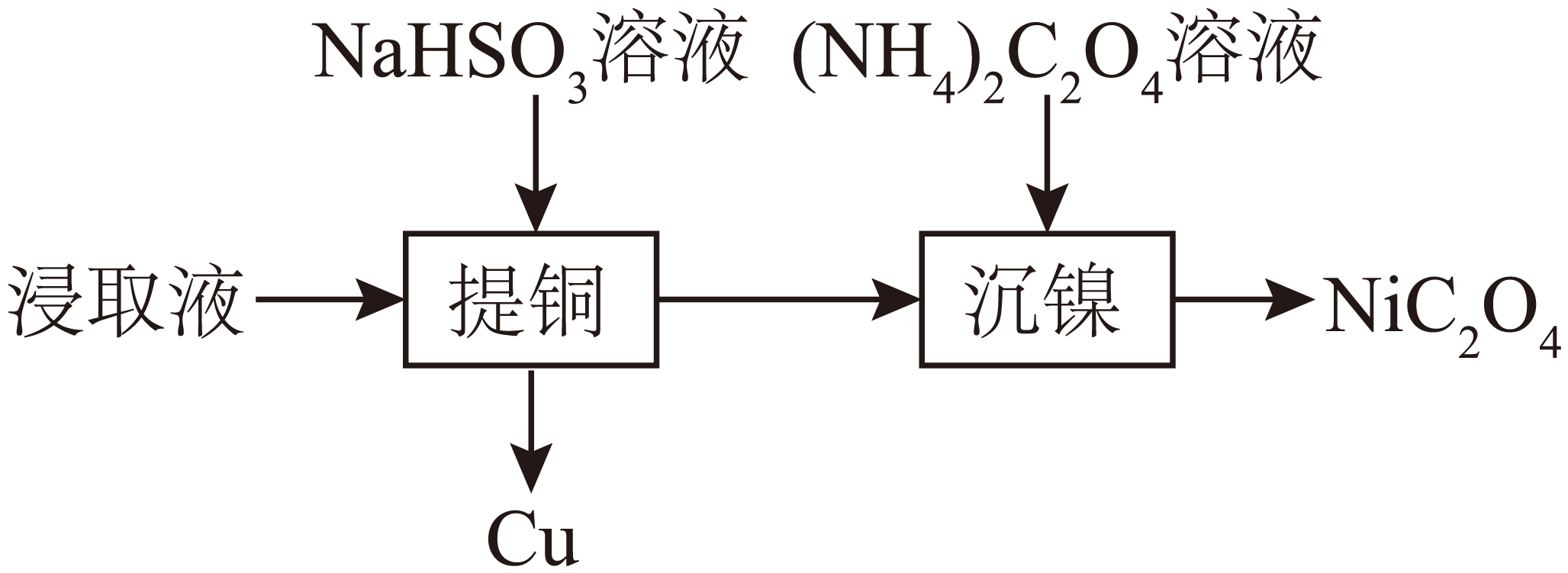
室温下,有色金属冶炼废渣$\rm ($含$\text{Cu}$、$\text{Ni}$、$\text{Si}$等的氧化物$\rm )$用过量的较浓${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$溶液酸浸后,提取铜和镍的过程如下所示。
已知:${{K}_{\text{a}}}\left( \text{HSO}_{4}^{-} \right)=1.2\times {{10}^{-2}},{{K}_{\text{a1}}}\left( {{\text{H}}_{2}}\text{S}{{\text{O}}_{3}} \right)=1.2\times {{10}^{-2}},{{K}_{\text{a}2}}\left( {{\text{H}}_{2}}\text{S}{{\text{O}}_{3}} \right)=6.0\times {{10}^{-8}}$。下列说法正确的是$(\quad\ \ \ \ )$
较浓${{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{4}}$溶液中:$c\\left( {{\\text{H}}^{+}} \\right)=2c\\left( \\text{SO}_{4}^{2-} \\right)+c\\left( \\text{O}{{\\text{H}}^{-}} \\right)$
","$\\text{NaHS}{{\\text{O}}_{3}}$溶液中:$2\\text{HSO}_{3}^{-}\\rightleftharpoons \\text{SO}_{3}^{2-}+{{\\text{H}}_{2}}\\text{S}{{\\text{O}}_{3}}$的平衡常数$K=5.0\\times {{10}^{-6}}$
","${{\\left( \\text{N}{{\\text{H}}_{4}} \\right)}_{2}}{{\\text{C}}_{2}}{{\\text{O}}_{4}}$溶液中:$c\\left( \\text{N}{{\\text{H}}_{3}}\\cdot {{\\text{H}}_{2}}\\text{O} \\right)+c\\left( \\text{O}{{\\text{H}}^{-}} \\right)=c\\left( {{\\text{H}}_{2}}{{\\text{C}}_{2}}{{\\text{O}}_{4}} \\right)+c\\left( \\text{H}{{\\text{C}}_{2}}\\text{O}_{4}^{-} \\right)+c\\left( {{\\text{H}}^{+}} \\right)$
","“提铜”和“沉镍”后的两份滤液中:${{ {c}}_{提铜}}\\left( \\text{N}{{\\text{a}}^{+}} \\right)={{ {c}}_{沉镍}}\\left( \\text{N}{{\\text{a}}^{+}} \\right)$
"]有色金属冶炼废渣$\rm ($含$\text{Cu}$、$\text{Ni}$、$\text{Si}$等的氧化物$\rm )$用过量的较浓${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$溶液酸浸后,浸取液主要含有$\text{CuS}{{\text{O}}_{\text{4}}}$、$\text{NiS}{{\text{O}}_{4}}$,加入$\text{NaHS}{{\text{O}}_{\text{3}}}$溶液提铜,滤液加入${{\left( \text{N}{{\text{H}}_{\text{4}}} \right)}_{\text{2}}}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$溶液沉镍得到$\text{Ni}{{\text{C}}_{\text{2}}}{{\text{O}}_{\text{4}}}$。
$\rm A$.若${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$两步均完全电离,则溶液中存在电荷守恒:$c\left( {{\text{H}}^{+}} \right)=2c\left( \text{SO}_{4}^{2-} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,但根据题给信息${{K}_{\text{a}}}\left( \text{HSO}_{4}^{-} \right)=1.2\times {{10}^{-2}}$知,在较浓的${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$溶液中${{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}$仅第一步电离完全,电离出大量的${{\text{H}}^{+}}$会抑制第二步电离,第二步电离不完全,溶液中存在$\text{HSO}_{4}^{-}$,因此电荷守恒应表示为$c\left( {{\text{H}}^{+}} \right)=c\left( \text{HSO}_{\text{4}}^{-} \right)+2c\left( \text{SO}_{\text{4}}^{\text{2-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,$\rm A$错误;
$\rm B$.该反应的平衡常数$K=\dfrac{c\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}} \right)\cdot c\left( \text{SO}_{\text{3}}^{\text{2-}} \right)}{{{c}^{2}}\left( \text{HSO}_{\text{3}}^{-} \right)}=\dfrac{c\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}} \right)}{c\left( {{\text{H}}^{+}} \right)\cdot c\left( \text{HSO}_{\text{3}}^{-} \right)}\cdot \dfrac{c\left( {{\text{H}}^{+}} \right)\cdot c\left( \text{SO}_{\text{3}}^{\text{2-}} \right)}{c\left( \text{HSO}_{\text{3}}^{-} \right)}=\dfrac{{{K}_{\text{a2}}}\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}} \right)}{{{K}_{\text{a1}}}\left( {{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{3}}} \right)}=\dfrac{6.0\times {{10}^{-8}}}{1.2\times {{10}^{-2}}}=5.0\times {{10}^{-6}}$,$\rm B$正确;
$\rm C$.$\text{NH}_{4}^{+}$得到$\rm 1$个$\text{O}{{\text{H}}^{-}}$生成$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$,${{\text{C}}_{2}}\text{O}_{4}^{2-}$得$\rm 1$个${{\text{H}}^{+}}$生成$\text{H}{{\text{C}}_{2}}\text{O}_{4}^{-}$得$\rm 2$个${{\text{H}}^{+}}$生成${{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}}$,水电离出的${{\text{H}}^{+}}$与$\text{O}{{\text{H}}^{-}}$浓度相等,即${{c}_{水}}\left( {{\text{H}}^{+}} \right)={{c}_{水}}\left( \text{O}{{\text{H}}^{-}} \right)$,则溶液中存在质子守恒$:{{c}_{水}}\left( \text{O}{{\text{H}}^{-}} \right)=c\left( \text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)=2c\left( {{\text{H}}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}} \right)+c\left( \text{H}{{\text{C}}_{2}}\text{O}_{4}^{-} \right)+c\left( {{\text{H}}^{+}} \right)={{c}_{水}}\left( {{\text{H}}^{+}} \right)$,$\rm C$错误;
$\rm D$.考虑过程中溶液的少量损耗$\rm ($吸附在沉淀表面被过滤除去$\rm )$,${{n}_{提铜}}\left( \text{N}{{\text{a}}^{+}} \right)\gt {{n}_{沉镍}}\left( \text{N}{{\text{a}}^{+}} \right)$,同时“沉镍”过程中加入了${{\left( \text{N}{{\text{H}}_{4}} \right)}_{2}}{{\text{C}}_{2}}{{\text{O}}_{4}}$溶液,溶液体积增加,因此${{c}_{提铜}}\left( \text{N}{{\text{a}}^{+}} \right)\gt {{c}_{沉镍}}\left( \text{N}{{\text{a}}^{+}} \right)$,$\rm D$错误;
故选:$\rm B$
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
