| 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
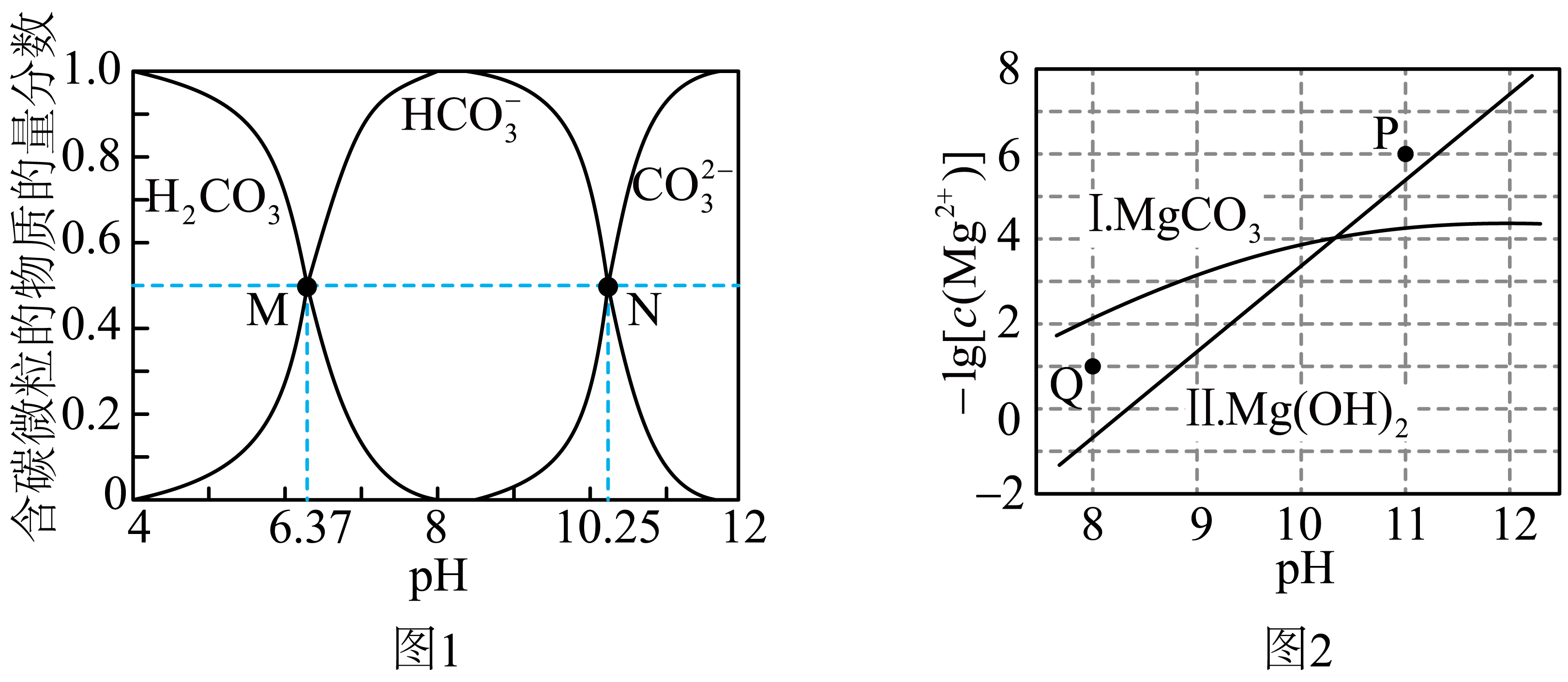
室温下,$\rm N{{a}_{2}}C{{O}_{3}}$体系中各含碳微粒的物质的量分数与$\rm pH$的关系如图$\rm 1$所示。在${{c}_{起始}}\rm (N{{a}_{2}}C{{O}_{3}})=0.1\rm \ mol\cdot {{L}^{-1}}$的体系中,研究$\rm M{{g}^{2+}}$在不同$\rm pH$时的可能产物,$c{\rm (M{{g}^{2+}})}$与$\rm pH$的关系如图$\rm 2$所示$\rm ($忽略溶液体积变化$\rm )$,曲线Ⅰ的离子浓度关系符合$c{\rm (M{{g}^{2+}})}\cdot c{\rm (CO_{3}^{2-})}={{K}_{\rm sp}}\rm (MgC{{O}_{3}})$,曲线Ⅱ的离子浓度关系符合$c{\rm (M{{g}^{2+}})}\cdot {{c}^{2}}{\rm (OH)}={{K}_{\rm sp}}\rm \left[ Mg{{(OH)}_{2}} \right]$。下列说法错误的是$\rm (\qquad)$
室温下,${{K}_{\\rm a1}}{\\rm ({{H}_{2}}C{{O}_{3}})}\\cdot {{K}_{\\rm a2}}{\\rm ({{H}_{2}}C{{O}_{3}})}\\lt {{K}_{\\rm w}}$
","$\\rm N{{a}_{2}}C{{O}_{3}}$溶液中存在:$c{\\rm ({{H}^{+}})}+c{\\rm (HCO_{3}^{-})}+2c{\\rm ({{H}_{2}}C{{O}_{3}})}=c{\\rm (O{{H}^{-}})}$
","$\\rm Q$点的体系中,发生反应的离子方程式为$\\rm M{{g}^{2+}}+2HCO_{3}^{-}=Mg{{(OH)}_{2}}\\downarrow +2C{{O}_{2}}\\uparrow $
","$\\rm P$点的体系中,$c{\\rm (HCO_{3}^{-})}+c{\\rm (CO_{3}^{2-})}+c{\\rm ({{H}_{2}}C{{O}_{3}})}=0.1\\rm \\ mol\\cdot {{L}^{-1}}$
"]$\rm A$.根据图$\rm 1$,当$\rm pH=10.25$时$\rm (N$点$\rm )$,溶液中$c{\rm (HCO_{3}^{-})}=c{\rm (CO_{3}^{2-})}$,则${K}_{{\rm a2}} = \dfrac{c{\rm ({{{CO}}}_{3}^{2 - })} \cdot c( {{\rm H}}^{ + }) }{c\rm ( {{{HCO}}}_{3}^{ - }) } = c\left( {{\rm H}}^{ + }\right) = {10}^{-{10.25}}$,同理可利用$\rm M$点求出$ {{K}_{\rm a1}}\rm ( {{H}_{2}}C{{O}_{3}})={{10}^{-6.37}}$,室温下,${{K}_{\rm a1}}{\rm ({{H}_{2}}C{{O}_{3}})}\cdot {{K}_{\rm a2}}{\rm ({{H}_{2}}C{{O}_{3}})}\lt {{K}_{\rm w}}=1{{0}^{-14}}$,$\rm A$项正确。
$\rm B$.根据质子守恒,$\rm N{{a}_{2}}C{{O}_{3}}$溶液中存在:$c{\rm ({{H}^{+}})}+c{\rm (HCO_{3}^{-})}+2c{\rm ({{H}_{2}}C{{O}_{3}})}=c{\rm (O{{H}^{-}})}$,$\rm B$项正确。
$\rm C$.$\rm Q$点的体系中,观察图$\rm 2$的横坐标和纵坐标可知$\rm pH=8$,$- \lg c{\rm ({{{\rm Mg}}}^{2 + })} = 1$,观察图$\rm 1$可知,$\rm pH=8$时,溶液中主要含碳微粒是$\rm HCO_{3}^{-}$,该点位于$\rm Mg{{( OH)}_{2}}$曲线Ⅱ的上方,图$\rm 2$中图像的纵坐标是$-\lg c{\rm (M{{g}^{2+}})}$,数值从下往上在增大,即是从下往上$c{\rm (M{{g}^{2+}})}$在减小,因此位于曲线上方离子浓度小的点是未生成该沉淀,位于曲线下方离子浓度大的点会生成该沉淀,$\rm Q$点位于$\rm MgC{{O}_{3}}$曲线下方和$\rm Mg{{(OH)}_{2}}$曲线上方,因此会生成碳酸镁沉淀,因此反应的离子方程式为$\rm M{{g}^{2+}}+2HCO_{3}^{-}=MgC{{O}_{3}}\downarrow +C{{O}_{2}}\uparrow +{{H}_{2}}O$,$\rm C$项错误。
$\rm D$.$\rm P$点位于曲线$\rm I$、Ⅱ的上方,不会生成碳酸镁沉淀和氢氧化镁沉淀,${{c}_{起始}}\rm (N{{a}_{2}}C{{O}_{3}})=0.1\ mol\cdot {{L}^{-1}}$,根据物料守恒,溶液中$c{\rm (HCO_{3}^{-})}+c{\rm (CO_{3}^{2-})}+c{\rm ({{H}_{2}}C{{O}_{3}})}=0.1\rm \ mol\cdot {{L}^{-1}}$,$\rm D$项正确。
故选:$\rm C$
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
