高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
高锰酸钾生产过程中产生的废锰渣$\rm ($主要成分为$\rm Mn{{O}_{2}}$、$\rm KOH$、$\rm MgO$和$\rm F{{e}_{2}}{{O}_{3}})$可用于制备$\rm MnS{{O}_{4}}$晶体,工艺流程如图所示。已知:硫铁矿主要成分为$\rm Fe{{S}_{2}}($杂质不参与反应$\rm )$。
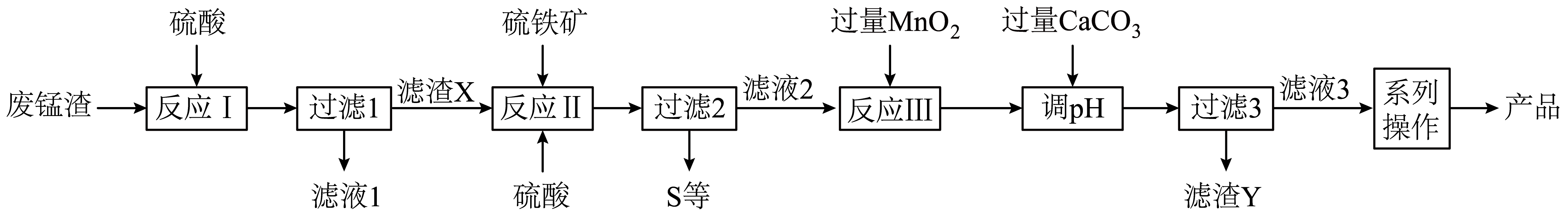
该工艺条件下金属离子开始沉淀和沉淀完全的$\rm pH$如下表所示。
| 金属离子 | $\rm F{{e}^{3+}}$ | $\rm F{{e}^{2+}}$ | $\rm M{{n}^{2+}}$ | $\rm M{{g}^{2+}}$ |
| 开始沉淀$\rm pH$ | $\rm 2.10$ | $\rm 7.45$ | $\rm 9.27$ | $\rm 9.60$ |
| 完全沉淀$\rm pH$ | $\rm 3.20$ | $\rm 8.95$ | $\rm 10.87$ | $\rm 11.13$ |
回答下列问题:
在实验室进行过滤操作,下列仪器不需要用到的是 $\rm ($填名称$\rm )$。
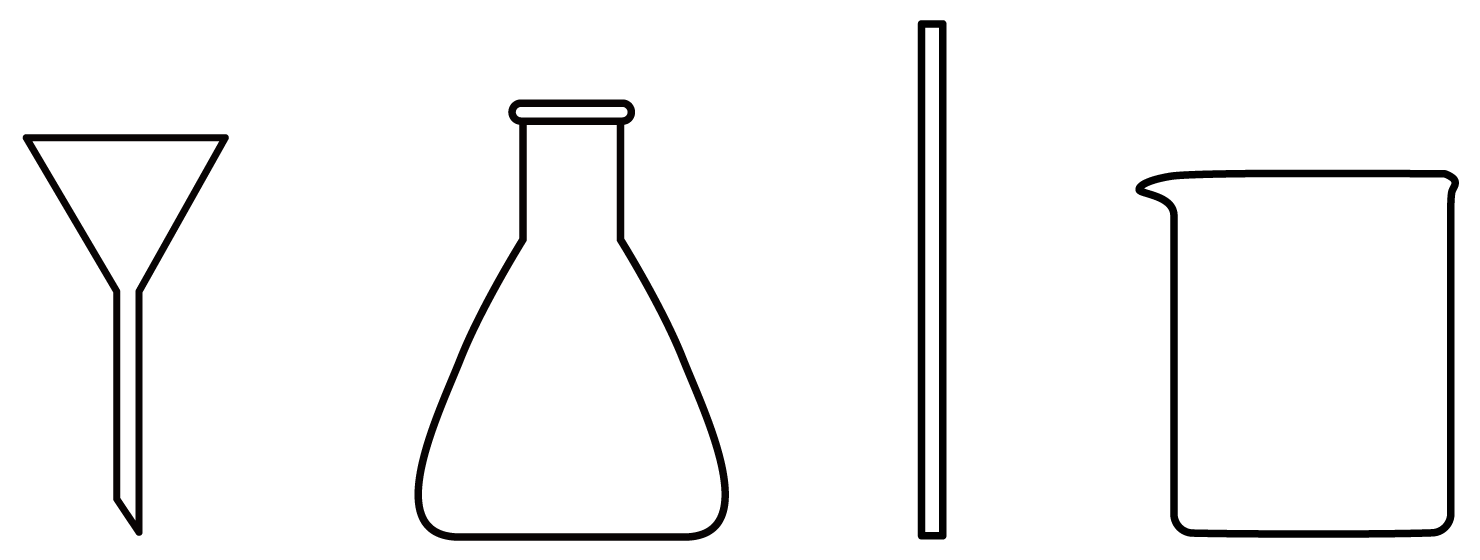
锥形瓶
"]]过滤操作仪器有漏斗、烧杯、玻璃棒,不需要锥形瓶。
$\rm Fe{{S}_{2}}$的结构类似于$\rm N{{a}_{2}}{{O}_{2}}$,是一种过硫化物,与酸反应生成$\rm {{H}_{2}}{{S}_{2}}$,$\rm {{H}_{2}}{{S}_{2}}$类似于$\rm {{H}_{2}}{{O}_{2}}$,易分解,实验室制取$\rm {{H}_{2}}S$时,某学生误将$\rm Fe{{S}_{2}}$颗粒当作$\rm FeS$使用,当$\rm Fe{{S}_{2}}$和足量盐酸反应完全后,不可能生成的物质为 $\rm ($填字母$\rm )$。
$\rm A$.$\rm {{H}_{2}}S$
$\rm B$.$\rm S$
$\rm C$.$\rm FeS$
$\rm D$.$\rm FeC{{l}_{2}}$
$\\rm C$
"]]$\rm FeS_{2}$与盐酸反应:$\rm FeS_{2}+2HCl=FeCl_{2}+H_{2}S_{2}$,$\rm H_{2}S_{2}$分解生成$\rm H_{2}S$和$\rm S$,不会生成$\rm FeS$。
“反应Ⅱ”中发生反应的离子方程式为 ;“反应Ⅲ”加入$\rm Mn{{O}_{2}}$的目的是 ;检验“反应Ⅲ”完全反应的实验操作是 。
$\\rm 2Fe{{S}_{2}}+3Mn{{O}_{2}}+12{{H}^{+}} = 4S+2F{{e}^{3+}}+3M{{n}^{2+}}+6{{H}_{2}}O$;将溶液中的$\\rm F{{e}^{2+}}$氧化为$\\rm F{{e}^{3+}}$;取少量“反应Ⅲ”的溶液于试管中,加入$\\rm {{K}_{3}}\\left[ Fe{{(CN)}_{6}} \\right]$溶液,若没有生成蓝色沉淀,则$\\rm F{{e}^{2+}}$已经全部氧化为$\\rm F{{e}^{3+}}$
"]]反应Ⅱ为$\rm MnO_{2}$与硫铁矿在酸性条件下发生氧化还原反应,其化学方程式为$\rm 2Fe{{S}_{2}}+3Mn{{O}_{2}}+6{{H}_{2}}S{{O}_{4}} = 4S+F{{e}_{2}}{{(S{{O}_{4}})}_{3}}+3MnS{{O}_{4}}+6{{H}_{2}}O$,离子方式为$\rm 2Fe{{S}_{2}}+3Mn{{O}_{2}}+12{{H}^{+}} = 4S+2F{{e}^{3+}}+3M{{n}^{2+}}+6{{H}_{2}}O$;反应Ⅲ加$\rm MnO_{2}$是将$\rm F{{e}^{2+}}$氧化成$\rm F{{e}^{3+}}$,其反应为$\rm Mn{{O}_{2}}+2F{{e}^{3+}}+4{{H}^{+}}=M{{n}^{2+}}+2F{{e}^{2+}}+2{{H}_{2}}O$;检验“反应Ⅲ”是否完全反应,只需要检验溶液中是否存在$\rm F{{e}^{2+}}$即可,取少量“反应Ⅲ”的溶液于试管中,加入$\rm {{K}_{3}}\left[ Fe{{(CN)}_{6}} \right]$溶液,若没有生成蓝色沉淀,则$\rm F{{e}^{2+}}$已经全部氧化为$\rm F{{e}^{3+}}$。
“调$\rm pH$”时,应控制溶液$\rm pH$的范围为 ;滤渣$\rm Y$的成分为 $\rm ($填化学式$\rm )$;“系列操作”为 。
$\\rm 3.20\\le pH\\lt 9.27$;$\\rm Fe{{(OH)}_{3}}$、$\\rm {CaSO}_4$、$\\rm Mn{{O}_{2}}$、$\\rm CaC{{O}_{3}}$;蒸发浓缩、冷却结晶、过滤、洗涤、干燥
"]]“调$\rm pH$”使$\rm F{{e}^{3+}}$沉淀,不沉淀$\rm M{{n}^{2+}}$,由表中数据可知,$\rm pH$范围$\rm 3.20\le pH\lt 9.27$;由分析知滤渣$\rm Y$为$\rm Fe{{(OH)}_{3}}$、微溶的$\rm {CaSO}_4$、未反应的$\rm Mn{{O}_{2}}$和$\rm CaC{{O}_{3}}$;最后将溶液经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到硫酸锰产品。
若产品的纯度较低,进一步提纯的方法是 。
重结晶
"]]由于产品$\rm MnSO_{4}$溶解度随温度变化大,重结晶可以进一步提纯$\rm MnSO_{4}$。
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
