| 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
常温下,向一定浓度二元弱酸$\rm H_{2}A$溶液中加入$\rm KOH(s)$,保持溶液体积和温度不变,测得$\rm pH$与$-\lg \text{X}\rm [X$为$c\left( {{\text{H}}_{\text{2}}}\text{A} \right)$、$c\text{(}{{\text{A}}^{\text{2-}}}\text{)}$、$\dfrac{c({{\text{A}}^{2-}})}{c(\text{H}{{\text{A}}^{-}})}\rm ]$变化如图所示。下列说法正确的是$(\quad\ \ \ \ )$
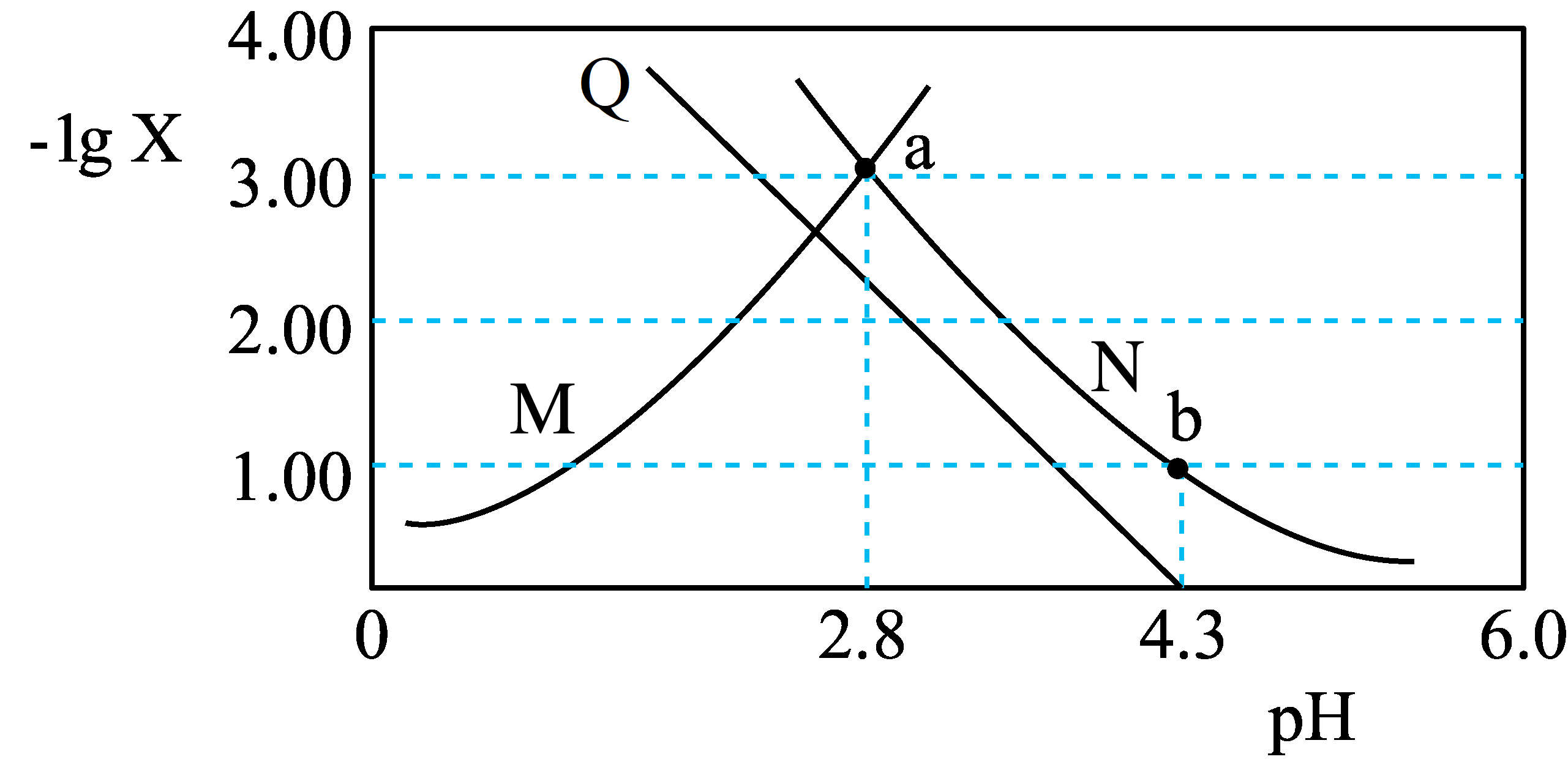
曲线$\\rm Q$代表$\\rm pH$与$-\\lg \\,c({{\\text{A}}^{2-}})$变化关系
","常温下,$\\rm H_{2}A$的${{K}_{\\text{a1}}}={{10}^{-4.3}}$
","$\\rm a$点溶液中:$c({{\\text{K}}^{+}})-c(\\text{O}{{\\text{H}}^{-}})=c(\\text{H}{{\\text{A}}^{-}})+2c\\text{(}{{\\text{H}}_{\\text{2}}}\\text{A})$
","$\\rm b$点溶液中:$c(\\text{H}{{\\text{A}}^{-}})=c({{\\text{A}}^{2-}})$
"]常温下,向一定浓度二元弱酸$\rm H_{2}A$溶液中加入$\rm KOH(s)$,由于两者发生反应,所以$\rm H_{2}A$逐渐减少,$-\text{lg}\,c\left( {{\text{H}}_{\text{2}}}\text{A} \right)$会逐渐增大,所以图中呈上升趋势的为$-\text{lg}\,c\left( {{\text{H}}_{\text{2}}}\text{A} \right)$与$\rm pH$变化关系,为曲线$\rm M$;${{\text{H}}_{\text{2}}}\text{A}\rightleftharpoons {{\text{H}}^{+}}\text{+H}{{\text{A}}^{-}}$,$\text{H}{{\text{A}}^{-}}\rightleftharpoons {{\text{H}}^{+}}+{{\text{A}}^{\text{2-}}}$,$\rm A^{2-}$逐渐增大,$-\text{lg}\,c\left( {{\text{A}}^{2-}} \right)$会之间减小,故呈下降趋势且与横坐标无交点的为$-\text{lg}\,c\left( {{\text{A}}^{2-}} \right)$,为$\rm N$;另一条则是$-\lg \,\dfrac{c({{\text{A}}^{2-}})}{c(\text{H}{{\text{A}}^{-}})}$与$\rm pH$的关系图,为$\rm Q$。
$\rm A$.根据分析,曲线$\rm N$代表$\rm pH$与$-\text{lg}\,c\left( {{\text{A}}^{2-}} \right)$变化关系,$\rm A$错误;
$\rm B$.$\rm M$与$\rm N$的交点:$c\left( {{\text{H}}_{\text{2}}}\text{A} \right)=c\left( {{\text{A}}^{\text{2}}}^{-} \right)$,${{K}_{\text{a1}}}{{K}_{\text{a2}}}=\dfrac{{{c}^{\text{2}}}\text{(}{{\text{H}}^{+}}\text{)}c\text{(}{{\text{A}}^{\text{2-}}}\text{)}}{c\text{(}{{\text{H}}_{\text{2}}}\text{A)}}={{({{10}^{-2.8}})}^{2}}={{10}^{-5.6}}$,又$-\text{lg}\,\dfrac{c({{\text{A}}^{2-}})}{c(\text{H}{{\text{A}}^{-}})}=0$时$\rm pH=4.3$,即${{K}_{\text{a2}}}={{10}^{-4.3}}$,故${{K}_{\text{a1}}}=\dfrac{{{10}^{-5.6}}}{{{K}_{\text{a2}}}}={{10}^{-1.3}}$,$\rm B$错误;
$\rm C$.$\rm a$点溶液中存在电荷守恒:$c({{\text{K}}^{+}})+c({{\text{H}}^{+}})=c(\text{H}{{\text{A}}^{-}})+c(\text{O}{{\text{H}}^{-}})+2c({{\text{A}}^{2}}^{-})$,又$c\left( {{\text{H}}_{\text{2}}}\text{A} \right)=c\left( {{\text{A}}^{2-}} \right)$,故$c({{\text{K}}^{+}})-c(\text{O}{{\text{H}}^{-}})+c({{\text{H}}^{+}})=c(\text{H}{{\text{A}}^{-}})+2c({{\text{H}}_{\text{2}}}\text{A})$,$\rm a$点氢离子浓度大于$\rm 0$,故$c({{\text{K}}^{+}})-c(\text{O}{{\text{H}}^{-}})\lt c(\text{H}{{\text{A}}^{-}})+2c({{\text{H}}_{\text{2}}}\text{A})$, $\rm C$错误;
$\rm D$.$\rm b$点溶液$\rm pH=4.3$,即$-\text{lg}\dfrac{c({{\text{A}}^{2-}})}{c(\text{H}{{\text{A}}^{-}})}=0$,故$c(\text{H}{{\text{A}}^{-}})=c({{\text{A}}^{2-}})$,$\rm D$正确;
故选:$\rm D$
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
