| 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
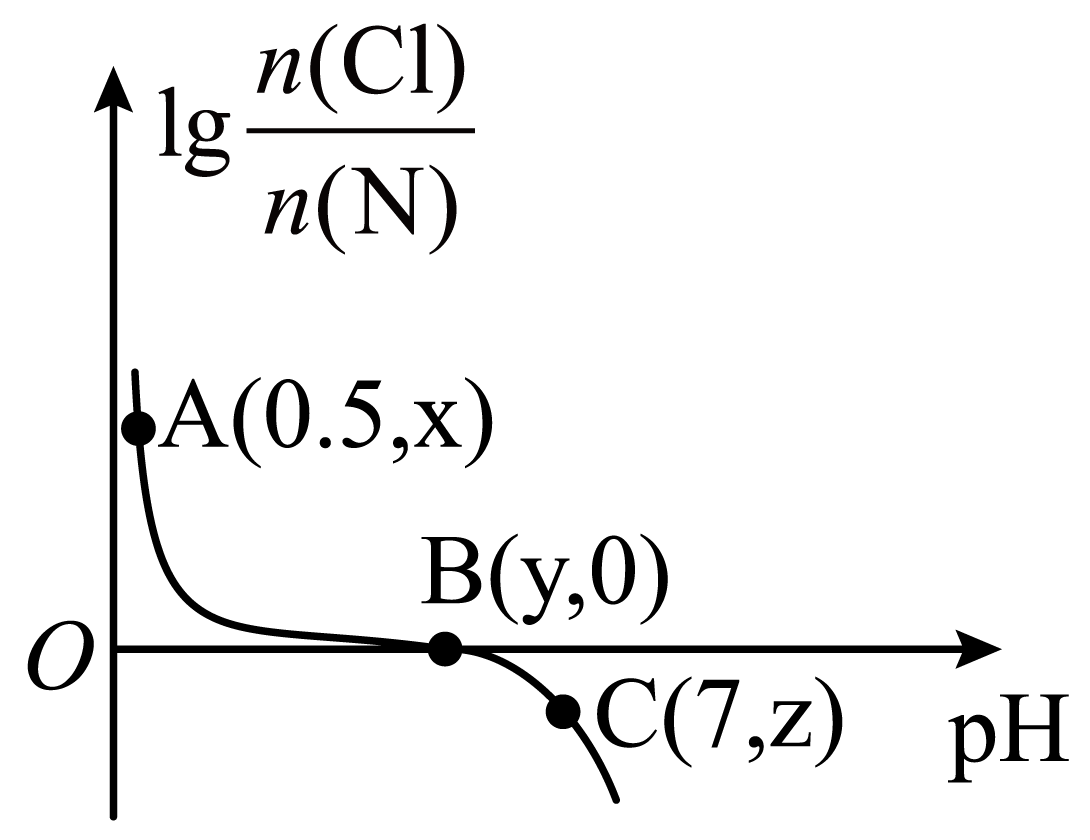
常温下,向$0.1\,\text{mol}/\text{L}$的稀氨水中通入氯化氢气体$\rm ($忽略溶液体积变化及溶液中$\text{N}{{\text{H}}_{3}}$的存在$\rm )$,溶液中$\text{lg}\,\dfrac{n\left( \text{Cl} \right)}{n\left( \text{N} \right)}$随$\text{pH}$的变化如图所示。已知:$n\left( \ \text{N} \right)=n\left( \text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O} \right)+n\left( \text{NH}_{4}^{+} \right)$;${{K}_{\text{b}}}\left( \text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O} \right)=2.0\times {{10}^{-5}}$,$\text{lg}\,2=0.30$。则下列说法正确的是$(\quad\ \ \ \ )$
$\\rm A$点:$c\\left( \\text{C}{{\\text{l}}^{-}} \\right)=2\\left[ c\\left( \\text{N}{{\\text{H}}_{3}}\\cdot {{\\text{H}}_{2}}\\text{O} \\right)+c\\left( \\text{NH}_{4}^{+} \\right) \\right]$
","$\\rm B$点:$c\\left( \\text{C}{{\\text{l}}^{-}} \\right)+c\\left( {{\\text{H}}^{+}} \\right)=2c\\left( \\text{N}{{\\text{H}}_{3}}\\cdot {{\\text{H}}_{2}}\\text{O} \\right)+c\\left( \\text{NH}_{4}^{+} \\right)+c\\left( \\text{O}{{\\text{H}}^{-}} \\right)$且$\\rm y$约等于$\\rm 5.15$
","$\\text{C}$点:$c\\left( \\text{N}{{\\text{H}}_{3}}\\cdot {{\\text{H}}_{2}}\\text{O} \\right)=\\dfrac{20}{201}\\,\\,\\text{mol}/\\text{L}$
","水的电离程度$\\text{B}\\gt \\text{A}\\gt \\text{C}$
"]根据图像知,氨水中通入$\rm HCl$气体,曲线由$\rm C$向$\rm A$变化,$\rm B$点$\text{lg}\,\dfrac{c\text{(Cl)}}{c\text{(N)}}=0$,$n\left( \text{Cl} \right)=n\left( \text{N} \right)$,恰好中和,溶质只有$\rm NH_{4}Cl$,$\rm B$点左侧$\rm HCl$过量,$\rm B$点右侧$\text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O}$过量,据此解答。
$\rm A$.当溶液中溶质为浓度均为$\rm 0.1$ $\rm mol/L$的$\rm NH_{4}Cl$和$\rm HCl$时溶液中物料守恒为$c\left( \text{C}{{\text{l}}^{-}} \right)=2[c\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)+c(\text{NH}_{4}^{+})]$,$\rm A$点$\rm pH=0.5$,$c\left( {{\text{H}}^{+}} \right)={{10}^{-0.5}}\,\text{mol/L}\gt 0.1\,\text{mol/L}$,$\rm A$点溶液中$\rm HCl$的浓度大于$\rm NH_{4}Cl$的浓度,则$c\left( \text{C}{{\text{l}}^{-}} \right)\gt 2[c\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)+c(\text{NH}_{4}^{+})]$,故$\rm A$错误;
$\rm B$.根据分析可知,$\rm B$点溶液中$\text{lg}\,\dfrac{n\left( \text{Cl} \right)}{n\left( \text{N} \right)}=0$,溶液为$\rm 0.1$ $\rm mol/L$ $\rm NH_{4}Cl$溶液,溶液中电荷守恒$c\left( \text{C}{{\text{l}}^{-}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)=c\left( \text{NH}_{4}^{+} \right)+c\left( {{\text{H}}^{+}} \right)$,物料守恒为$c\left( \text{C}{{\text{l}}^{-}} \right)=c\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)+c(\text{NH}_{4}^{+})$,两式整理得$c\left( \text{C}{{\text{l}}^{-}} \right)+c\left( {{\text{H}}^{+}} \right)=2c\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)+c\left( \text{NH}_{\text{4}}^{+} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$,若设水解的$c\left( \text{NH}_{4}^{+} \right)=a\,\text{mol/L}$,则: $\begin{matrix} {} & \text{NH}_{4}^{+} & + & {{\text{H}}_{\text{2}}}\text{O} & \overset{{}}{\mathop{\rightleftharpoons }}\, & \text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O} & + & {{\text{H}}^{+}} \\起始量 \text{mol/L} & 0.1 & {} & {} & {} & 0 & {} & 0 \\转化量 \text{mol/L} & a & {} & {} & {} & a & {} & a \\ 平衡量\text{mol/L} & 0.1-a\approx 0.1 & {} & {} & {} & a & {} & a \\ \end{matrix}$,由${{K}_{\text{h}}}=\dfrac{{{K}_{\text{w}}}}{{{K}_{\text{b}}}}$,得$\dfrac{{{a}^{2}}}{0.1}=\dfrac{{{10}^{-14}}}{2\times {{10}^{-5}}}$,解得$a={{\left( \dfrac{1}{2} \right)}^{\dfrac{1}{2}}}\times {{10}^{-5}}$,$\rm pH=5.15$,即$y=5.15$,故$\rm B$正确;
$\rm C$.由$\rm c$点$\rm pH=7$,结合电荷守恒得:$c\left( \text{NH}_{\text{4}}^{+} \right)=c\left( \text{C}{{\text{l}}^{-}} \right)$,又知$c(\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{\text{2}}}\text{O})+c(\text{NH}_{4}^{+})=0.1\,\text{mol/L}$,${{K}_{\text{b}}}\left( \text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)=\dfrac{c\left( \text{NH}_{\text{4}}^{+} \right)c\left( \text{O}{{\text{H}}^{-}} \right)}{c\left( \text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O} \right)}=\dfrac{c\left( \text{NH}_{\text{4}}^{+} \right)\times {{10}^{-7}}}{0.1-c\left( \text{NH}_{\text{4}}^{+} \right)}=2.0\times {{10}^{-5}}$,得$c\left( \text{NH}_{4}^{+} \right)=\dfrac{20}{201}\,\,\text{mol}/\text{L}$,$c\left( \text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O} \right)=\dfrac{0.1}{201}\,\,\text{mol}/\text{L}$,故$\rm C$错误;
$\rm D$.$\rm B$点溶质只有$\rm NH_{4}Cl$,水的电离程度最大,$\rm C$点显中性,$\text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O}$稍过量,溶质为$\rm NH_{4}Cl$和少量$\text{N}{{\text{H}}_{\text{3}}}\cdot {{\text{H}}_{\text{2}}}\text{O}$,$\rm A$点显强酸性,溶质为$\rm NH_{4}Cl$和大量$\rm HCl$,$\rm A$点水的电离程度小于$\rm C$点,综上得水的电离程度:$\rm B\gt C\gt A$,故$\rm D$错误;
故选:$\rm B$
| 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
