高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
丙烯是一种重要的有机化工原料,可以制取聚丙烯、丙烯腈、丙酮等化工产品。工业上可采用丙烷催化脱氢法制备丙烯,反应如下:
主反应:${{\text{C}}_{3}}{{\text{H}}_{8}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{3}}{{\text{H}}_{6}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\qquad\Delta{{H}_{1}}$
副反应:${{\text{C}}_{3}}{{\text{H}}_{8}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{2}}{{\text{H}}_{4}}\left( \text{g} \right)+\text{C}{{\text{H}}_{4}}\left( \text{g} \right)\qquad\Delta{{H}_{2}}=+81.7\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
${{\text{C}}_{3}}{{\text{H}}_{8}}\left( \text{g} \right)\rightleftharpoons 3\text{C}\left( \text{s} \right)+4{{\text{H}}_{2}}\left( \text{g} \right)\qquad\Delta{{H}_{3}}=+106\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
请回答:
几种物质的燃烧热$\rm (25\;\rm ^\circ\rm C$,$101\;\rm \text{kPa}\rm )$如下表所示:则$\text{ }\!\!\Delta{{H}_{1}}=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
| 化学式$\rm ($状态$\rm )$ | ${{\text{H}}_{2}}\left( \text{g} \right)$ | ${{\text{C}}_{3}}{{\text{H}}_{6}}\left( \text{g} \right)$ | ${{\text{C}}_{3}}{{\text{H}}_{8}}\left( \text{g} \right)$ |
| $\Delta H/\left( \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}} \right)$ | $\rm -286$ | $\rm -2058$ | $\rm -2220$ |
$\\rm +124$
"]]$\rm C_{3}H_{8}$燃烧热的热化学方程式:${\rm C_{3}H_{8}(g)+5O_{2}(g)=3CO_{2}(g)+4H_{2}O(l)}\qquad\Delta H=-2220\;\rm kJ·mol^{-1}$ ①;$\rm C_{3}H_{6}$燃烧热的热化学方程式:${\rm C_{3}H_{6}(g)+\dfrac{9}{2}\rm O_{2}(g)=3CO_{2}(g)+3H_{2}O(l)}\qquad\Delta H=-2058\;\rm kJ·mol^{-1}$ ②;$\rm H_{2}$燃烧热的热化学方程式:${{\text{H}}_{\text{2}}}\left( \text{g} \right)+\dfrac{\text{1}}{\text{2}}{{\text{O}}_{\text{2}}}\left( \text{g} \right)={{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\qquad\Delta H= - {286\;\rm kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$③。根据盖斯定律,①$\rm -$②$\rm -$③可得到反应Ⅰ,则$ \Delta H=-2220\;\rm kJ·mol^{-1}-(-2058\;\rm kJ·mol^{-1})-(-286\;\rm kJ·mol^{-1})=+124\;\rm kJ·mol^{-1}$;
假定体系内只发生反应${{\text{C}}_{3}}{{\text{H}}_{8}}\left( \text{g} \right)\rightleftharpoons {{\text{C}}_{3}}{{\text{H}}_{6}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)$,反应过程中温度保持不变,压强恒定为$P\text{ kPa}$,平衡时${{\text{C}}_{3}}{{\text{H}}_{8}}$转化率为$\alpha $,该温度下反应的平衡常数${{K}_{\rm p}}$为 $\text{kPa}\rm ($用平衡分压代替平衡浓度计算,分压$\rm =$总压$\rm \times $物质的量分数$\rm )$。
$\\dfrac{{{\\alpha }^{2}}}{1-{{\\alpha }^{2}}}P$
"]]温度保持不变,压强恒定为$ {P\rm \;kPa}$,设开始投放的$\mathrm{C}_{3} \mathrm{H}_{8} \left(\mathrm{g}\right)$物质的量为$\rm 1\;\rm mol$,平衡时${{\text{C}}_{3}}{{\text{H}}_{8}}$转化率为$\rm \alpha$,列三段式:$\begin{matrix} {} & {{\text{C}}_{\text{3}}}{{\text{H}}_{\text{8}}}\text{(g)} & \rightleftharpoons & {{\text{C}}_{\text{3}}}{{\text{H}}_{\text{6}}}\text{(g)} & + & {{\text{H}}_{\text{2}}} \\ 开始\text{(mol)} & 1 & {} & 0 & {} & 0 \\ 转化\text{(mol)} & \alpha & {} & \alpha & {} & \alpha \\ 平衡\text{(mol)} & 1-\alpha & {} & \alpha & {} & \alpha \\ \end{matrix}$,气体总的物质的量为$1+\alpha $,${{K}_{\rm p}}=\dfrac{\left( \dfrac{\alpha }{1+\alpha }{P\rm \;kPa} \right)\left( \dfrac{\alpha }{1+\alpha } {P\rm \;kPa} \right)}{\left( \dfrac{1-\alpha }{1+\alpha } {P\rm \;kPa} \right)}=\dfrac{{{\alpha}^{\text{2}}}}{ 1- \alpha} {P}$;
已知$\text{C}{{\text{O}}_{2}}$在一定条件下能发生如下反应:$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$,$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+\text{C}\left( \text{s} \right)\rightleftharpoons 2\text{CO}\left( \text{g} \right)$,研究表明在丙烷催化脱氢装置中通入一定量的$\text{C}{{\text{O}}_{2}}$能提高${{\text{C}}_{3}}{{\text{H}}_{6}}$的产量。试从两个不同角度解释原因 。
$\\text{C}{{\\text{O}}_{2}}$能与${{\\text{H}}_{2}}$反应,促进主反应平衡正向移动 $\\text{C}{{\\text{O}}_{2}}$与焦炭反应,可以减缓催化剂的失活
"]]$\text{C}{{\text{O}}_{2}}$能与${{\text{H}}_{2}}$反应,$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)$,降低${{\text{H}}_{2}}$浓度,促进主反应平衡正向移动;$\text{C}{{\text{O}}_{2}}$与焦炭反应$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+\text{C}\left( \text{s} \right)\rightleftharpoons 2\text{CO}\left( \text{g} \right)$,减少积碳,可以减缓催化剂的失活;
某实验小组在催化剂用量及其他实验条件相同时,测得丙烷的平衡转化率和丙烯的选择性$\rm ($转化的${{\text{C}}_{3}}{{\text{H}}_{8}}$中生成的${{\text{C}}_{3}}{{\text{H}}_{6}}$的百分比$\rm )$随温度的变化如图所示,下列说法正确的是$(\quad\ \ \ \ )$。
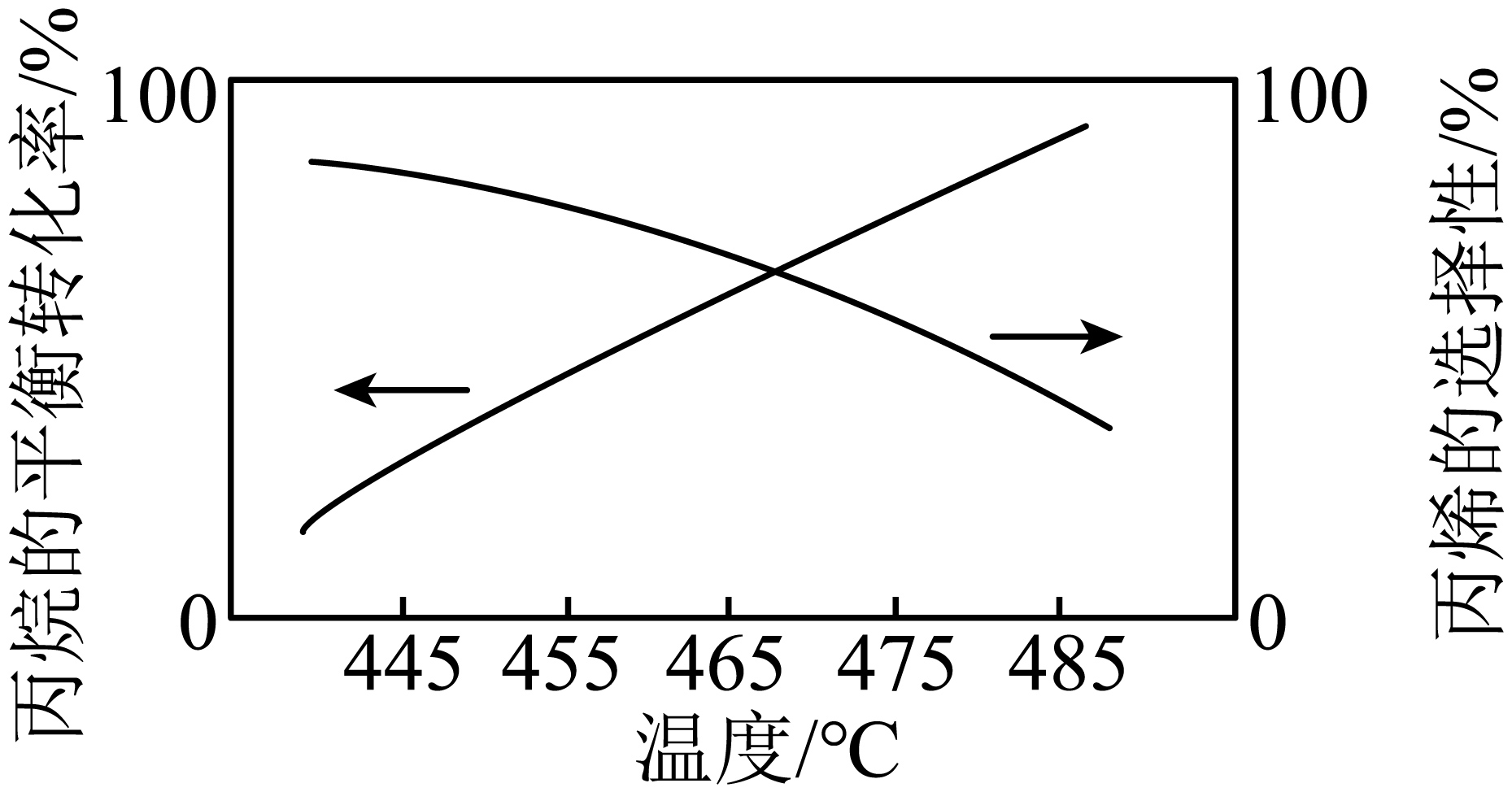
由图可知,随温度升高,$\\text{C}-\\text{H}$键比$\\text{C}-\\text{C}$键更活泼
","${{\\text{C}}_{3}}{{\\text{H}}_{8}}$的脱氢反应在任意温度下都能自发进行
","升高温度,降低压强,加入催化剂均可提高${{\\text{C}}_{3}}{{\\text{H}}_{8}}$的平衡转化率
","制备丙烯的合适温度需综合考虑丙烷转化率和丙烯选择性
"]$\rm A$.由图可知,随温度升高,丙烷的转化率升高,丙烯的选择性降低,说明$\text{C}-\text{H}$键更易反应,比$\text{C}-\text{C}$键更活泼,$\rm A$错误;
$\rm B$.该反应是吸热反应,$\Delta H\gt 0$;该反应是气体体积增加的反应,则$\Delta S\gt 0$;根据$\Delta G=\Delta H-T\Delta S$,使反应自发,即$ \Delta G\lt 0$,则温度越高越好,即高温有利于自发进行,$\rm B$错误;
$\rm C$.催化剂不能影响转化率,只影响速率,$\rm C$错误;
$\rm D$.丙烯的理论产量为丙烯的选择性与丙烷的平衡转化率乘积,故制备丙烯的合适温度需综合考虑丙烷转化率和丙烯选择性,$\rm D$正确;
故选:$\rm D$。
以丙烯为原料可以先制备丙烯腈$\rm (\text{C}{{\text{H}}_{2}}=\text{CHCN}\rm )$,再用丙烯腈电合成己二腈$\left[ \text{NC}{{\left( \text{C}{{\text{H}}_{2}} \right)}_{4}}\text{CN} \right]$,请写出酸性环境中电合成己二腈的电极反应式 。
$2\\text{C}{{\\text{H}}_{2}}=\\text{CHCN}+2{{\\text{H}}^{+}}+2{{\\text{e}}^{-}}=\\text{NC}{{\\left( \\text{C}{{\\text{H}}_{2}} \\right)}_{4}}\\text{CN}$
"]]$\text{C}{{\text{H}}_{2}}=\text{CHCN}$得电子在阴极被还原生成$\text{NC}{{\left( \text{C}{{\text{H}}_{2}} \right)}_{4}}\text{CN}$,电极反应为$2\text{C}{{\text{H}}_{2}}=\text{CHCN}+2{{\text{H}}^{+}}+2{{\text{e}}^{-}}=\text{NC}{{\left( \text{C}{{\text{H}}_{2}} \right)}_{4}}\text{CN}$;
以丙烯为原料还可以制备丙酮$\rm (\text{C}{{\text{H}}_{3}}\text{COC}{{\text{H}}_{3}}\rm )$。某兴趣小组在做实验时发现丙酮与氯仿$\rm (\text{CHC}{{\text{l}}_{3}}\rm )$混合时有放热现象,经查阅主要原因是混合时形成了某种特殊作用力。请结合物质结构知识分析形成这种作用力的原理 。
丙酮中的羰基氧具有较强的电负性$\\rm ($带有较强的负电荷$\\rm )$,而氯仿中的氢原子由于$\\rm 3$个氯原子的吸电子效应,具有一定的正电性$\\rm ($带有较强的正电荷$\\rm )$,混合时丙酮的氧原子与氯仿的氢原子之间会形成氢键而放热
"]]丙酮中的羰基氧具有较强的电负性$\rm ($带有较强的负电荷$\rm )$,而氯仿中的氢原子由于$\rm 3$个氯原子的吸电子效应,电子偏向于碳,使$\rm H$具有一定的正电性$\rm ($带有较强的正电荷$\rm )$,混合时丙酮的氧原子与氯仿的氢原子之间会形成氢键而放热。
高中 | 化学平衡常数题目答案及解析(完整版)
