高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
镓是一种战略金属元素,一种由湿法提锌浸出渣$\rm ($含$\rm Ga$、$\rm Pb$、$\rm Zn$、$\rm Fe$等元素的氧化物$\rm )$生产镓的流程如下:
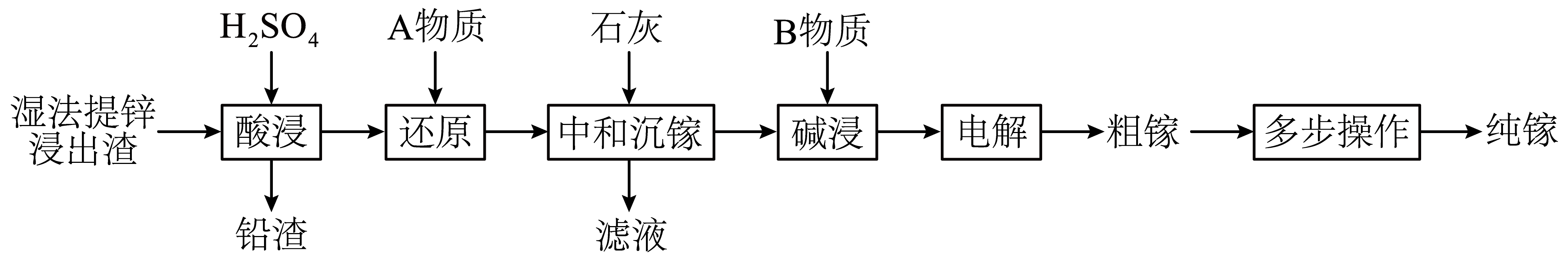
“酸浸”步骤中,随着湿法提锌浸出渣含$\rm Pb$量的升高,$\rm Ga$的浸出率降低的原因是 ,在含$\rm Pb$量不变的条件下,可提高$\rm Ga$浸出率的措施是 $\rm ($任答一点$\rm )$。
生成的$\\rm PbSO_{4}$难溶,包覆在含镓残渣表面使$\\rm Ga$的浸出率降低; 粉碎、搅拌、增加浸出时间、反复浸出、适当升高温度、适当提高酸的浓度
"]]酸浸时生成硫酸铅沉淀,则“酸浸”步骤中,随着湿法提锌浸出渣含$\rm Pb$量的升高,$\rm Ga$的浸出率降低的原因是:生成的$\rm PbSO_{4}$难溶,包覆在含镓残渣表面使$\rm Ga$的浸出率降低;增大反应物的浓度、增大接触面积、升温等均能加快反应速率,则在含$\rm Pb$量不变的条件下,可提高$\rm Ga$浸出率的措施是:粉碎、搅拌、增加浸出时间、反复浸出、适当升高温度、适当提高酸的浓度。
“还原”步骤中,若$\rm A$物质选择$\rm {{ZnS}}($难溶于水$\rm )$,可得到黄色沉淀,该步骤$\rm F{{e}^{3+}}$发生反应的离子方程式为 ,可用于证明$\rm F{{e}^{3+}}$反应完全的试剂是 $\rm ($填化学式$\rm )$。
$\\rm ZnS$ $\\rm +2Fe^{3+}=2Fe^{2+}+S↓+Zn^{2+}$或$\\rm H_{2}S+2Fe^{3+}=2Fe^{2+}+S↓+2H^{+}$ ;$\\rm KSCN$或$\\rm K_{4}[Fe(CN)_{6}]$
"]]“还原”步骤中,若$\rm A$物质选择$\rm {{ZnS}}($难溶于水$\rm )$,得到的黄色沉淀为硫单质,则该步骤中$\rm F{{e}^{3+}}$为氧化剂,由于所得溶液呈酸性,$\rm {{ZnS}}$或其转化生成的$\rm H_{2}S$为还原剂,则发生反应的离子方程式为$\rm ZnS +2Fe^{3+}=2Fe^{2+}+S↓+Zn^{2+}$或$\rm H_{2}S+2Fe^{3+}=2Fe^{2+}+S↓+2H^{+}$,铁离子与硫氰根离子生成血红色溶液、与$\rm K_{4}[Fe(CN)_{6}]$产生深蓝色沉淀,故可用于证明$\rm F{{e}^{3+}}$反应完全的试剂是$\rm KSCN$或$\rm K_{4}[Fe(CN)_{6}]$。
部分离子浓度${\rm pM[ pM=-lg}c{\rm (某离子)} ]$与$\rm pH$关系如下图所示。
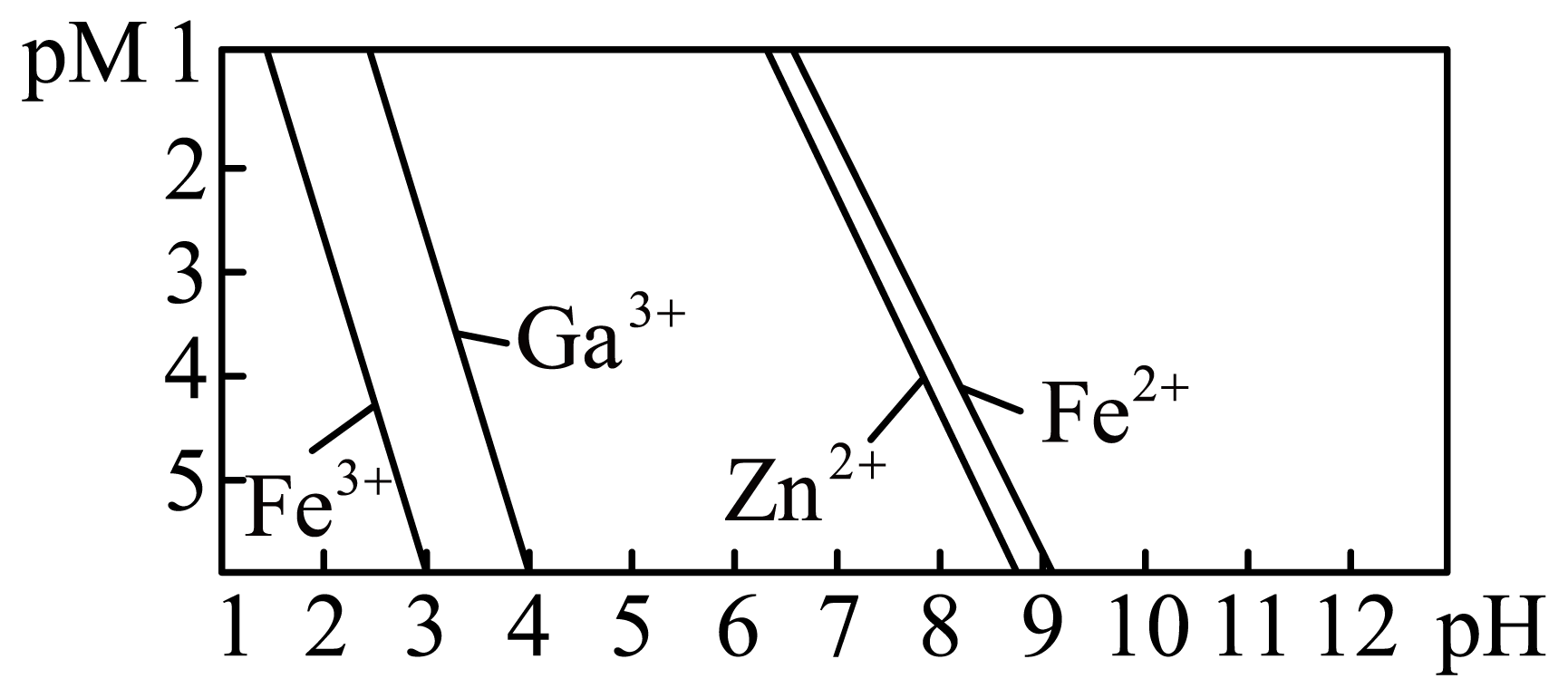
根据流程和图中信息判断“中和沉镓”后所得滤液中的主要过渡金属阳离子为 $\rm ($填离子符号$\rm )$。
$\\rm Fe^{2+}$、$\\rm Zn^{2+}$
"]]通常,金属离子浓度小于$\rm 10^{-5}\ mol/L$即图中该离子对应的$\rm pM\gt 5$时可认为沉淀完全,由图可知,镓离子沉淀完全时锌离子、亚铁离子尚未沉淀,则根据流程和图中信息判断“中和沉镓”后所得滤液中的主要过渡金属阳离子为$\rm Fe^{2+}$、$\rm Zn^{2+}$ $\rm ($填离子符号$\rm )$。
“电解”时需严格控制电解液$\rm pH$,若$\rm pH$过低可能造成的后果是 。
阴极氢离子放电产生氢气
"]]电解时,镓离子在阴极得到电子被还原生成镓,“电解”时需严格控制电解液$\rm pH$,若$\rm pH$过低,氢离子浓度过大,可能造成的后果是:阴极氢离子放电产生氢气。
已知镓的化学性质与铝相似,“碱浸”时为了节约成本,有研究人员提出$\rm B$物质使用氨水。已知$\rm 25\ ^\circ \text{C}$时,${\rm Ga{{(OH)}_{3}}+{{H}_{2}}O\rightleftharpoons {{[ Ga{{(OH)}_{4}} ]}^{-}}+{{H}^{+}}}\quad{{K}_{\rm a}}\rm \left[ Ga{{(OH)}_{3}} \right]=5\times {{10}^{-11}}$,${{K}_{\rm b}}\rm (N{{H}_{3}}\cdot {{H}_{2}}O)=1.8\times {{10}^{-5}}$。试通过计算推测该条件下$\rm Ga{{(OH)}_{3}}$在$\rm N{{H}_{3}}\cdot {{H}_{2}}O$中的溶解趋势。写出简要计算过程并得出结论: 。
反应$\\rm Ga(OH{{)}_{3}}+N{{H}_{3}}\\cdot {{H}_{2}}O={{\\left[ Ga{{(OH)}_{4}} \\right]}^{-}}+NH_{4}^{+}$的平衡常数$K=\\dfrac{c{\\rm (NH_{4}^{+})}\\left\\{ {{\\rm \\left[ Ga{{(OH)}_{4}} \\right]}^{-}} \\right\\}}{c{\\rm (N{{H}_{3}}\\cdot {{H}_{2}}O)}}=\\dfrac{c{\\rm (NH_{4}^{+})}\\left\\{ {{\\left[ {\\rm Ga}{{\\rm (OH)}_{4}} \\right]}^{-}} \\right\\}c{\\rm ({{H}^{+}})}\\cdot c{\\rm (O{{H}^{-}})}}{c{\\rm (N{{H}_{3}}\\cdot {{H}_{2}}O)}c{\\rm ({{H}^{+}})}\\cdot c{\\rm (O{{H}^{-}})}}=\\dfrac{{{K}_{\\rm a}}{\\rm \\left[ Ga{{(OH)}_{3}} \\right]}{{K}_{\\rm b}}\\rm (N{{H}_{3}}\\cdot {{H}_{2}}O)}{{{K}_{\\rm w}}}=9\\times {{10}^{-2}}$,一般来说,$K\\gt {{10}^{5}}$时反应基本完全了,则$K\\lt {{10}^{-5}}$时反应较难发生或者说逆向进行得比较完全,${{10}^{5}}\\gt K\\gt {{10}^{-5}}$为可逆反应,因为$\\rm {{10}^{5}}\\gt 9\\times {{10}^{-2}}\\gt {{10}^{-5}}$,所以可得到结论:$\\rm Ga(OH{{)}_{3}}+N{{H}_{3}}\\cdot {{H}_{2}}O={{\\left[ Ga{{(OH)}_{4}} \\right]}^{-}}+NH_{4}^{+}$正向可溶,或者$\\rm Ga{{(OH)}_{3}}$在$\\rm N{{H}_{3}}\\cdot {{H}_{2}}O$可溶,但是可逆反应。
"]]已知镓的化学性质与铝相似,“碱浸”时为了节约成本,有研究人员提出$\rm B$物质使用氨水。已知$\rm 25\ ^\circ \text{C}$时,${\rm Ga{{(OH)}_{3}}+{{H}_{2}}O\rightleftharpoons {{\left[ Ga{{(OH)}_{4}} \right]}^{-}}+{{H}^{+}}}\quad{{K}_{\rm a}}\rm \left[ Ga{{(OH)}_{3}} \right]=5\times {{10}^{-11}}$,${{K}_{\rm b}}\rm (N{{H}_{3}}\cdot {{H}_{2}}O)=1.8\times {{10}^{-5}}$。试通过计算推测该条件下$\rm Ga{{(OH)}_{3}}$在$\rm N{{H}_{3}}\cdot {{H}_{2}}O$中的溶解趋势:则有:反应$\rm Ga(OH{{)}_{3}}+N{{H}_{3}}\cdot {{H}_{2}}O={{\left[ Ga{{(OH)}_{4}} \right]}^{-}}+NH_{4}^{+}$的平衡常数$K=\dfrac{c{\rm (NH_{4}^{+})}\left\{ {{\left[ \rm Ga{{(OH)}_{4}} \right]}^{-}} \right\}}{c{\rm (N{{H}_{3}}\cdot {{H}_{2}}O)}}=\dfrac{c{\rm (NH_{4}^{+})}\left\{ {{\left[ {\rm Ga}{{\rm (OH)}_{4}} \right]}^{-}} \right\}c{\rm ({{H}^{+}})}\cdot c{\rm (O{{H}^{-}})}}{c{\rm (N{{H}_{3}}\cdot {{H}_{2}}O)}c{\rm ({{H}^{+}})}\cdot c{\rm (O{{H}^{-}})}}=\dfrac{{{K}_{\rm a}}{\rm \left[ Ga{{(OH)}_{3}} \right]}{{K}_{\rm b}}\rm (N{{H}_{3}}\cdot {{H}_{2}}O)}{{{K}_{\rm w}}}=9\times {{10}^{-2}}$,一般来说,$K\gt {{10}^{5}}$时反应基本完全了,则$K\lt {{10}^{-5}}$时反应较难发生或者说逆向进行得比较完全,${{10}^{5}}\gt K\gt {{10}^{-5}}$为可逆反应,因为${{10}^{5}}\gt 9\times {{10}^{-2}}\gt {{10}^{-5}}$,所以可得到结论:$\rm Ga(OH{{)}_{3}}+N{{H}_{3}}\cdot {{H}_{2}}O={{\left[ Ga{{(OH)}_{4}} \right]}^{-}}+NH_{4}^{+}$正向可溶,或者$\rm Ga{{(OH)}_{3}}$在$\rm N{{H}_{3}}\cdot {{H}_{2}}O$可溶,但是可逆反应。
高中 | 化学平衡常数题目答案及解析(完整版)
