高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
在保持$T\ {}^\circ \text{C}$、$600\,\text{kPa}$条件下,向密闭容器中充入$1\text{ mol N}{{\text{O}}_{2}}$气体,存在如下反应:$2\text{N}{{\text{O}}_{2}}(\text{g})\rightleftharpoons {{\text{N}}_{2}}{{\text{O}}_{4}}(\text{g})$。该反应的正、逆反应速率与$\text{N}{{\text{O}}_{2}}$、${{\text{N}}_{2}}{{\text{O}}_{4}}$的分压关系为:${{v}_{正}}={{k}_{正}}\cdot {{p}^{2}}\left( \text{N}{{\text{O}}_{2}} \right)$,${{v}_{逆}}={{k}_{逆}}\cdot p\left( {{\text{N}}_{2}}{{\text{O}}_{4}} \right)({{k}_{正}}$、${{k}_{逆}}$分别是正、逆反应的速率常数$\rm )$。$\lg {{v}_{正}}\sim\lg p\left( \text{N}{{\text{O}}_{2}} \right)$与$\lg {{v}_{逆}}\sim\lg p\left( {{\text{N}}_{2}}{{\text{O}}_{4}} \right)$的关系如图所示。结合图像,下列说法正确的是$(\quad\ \ \ \ )$
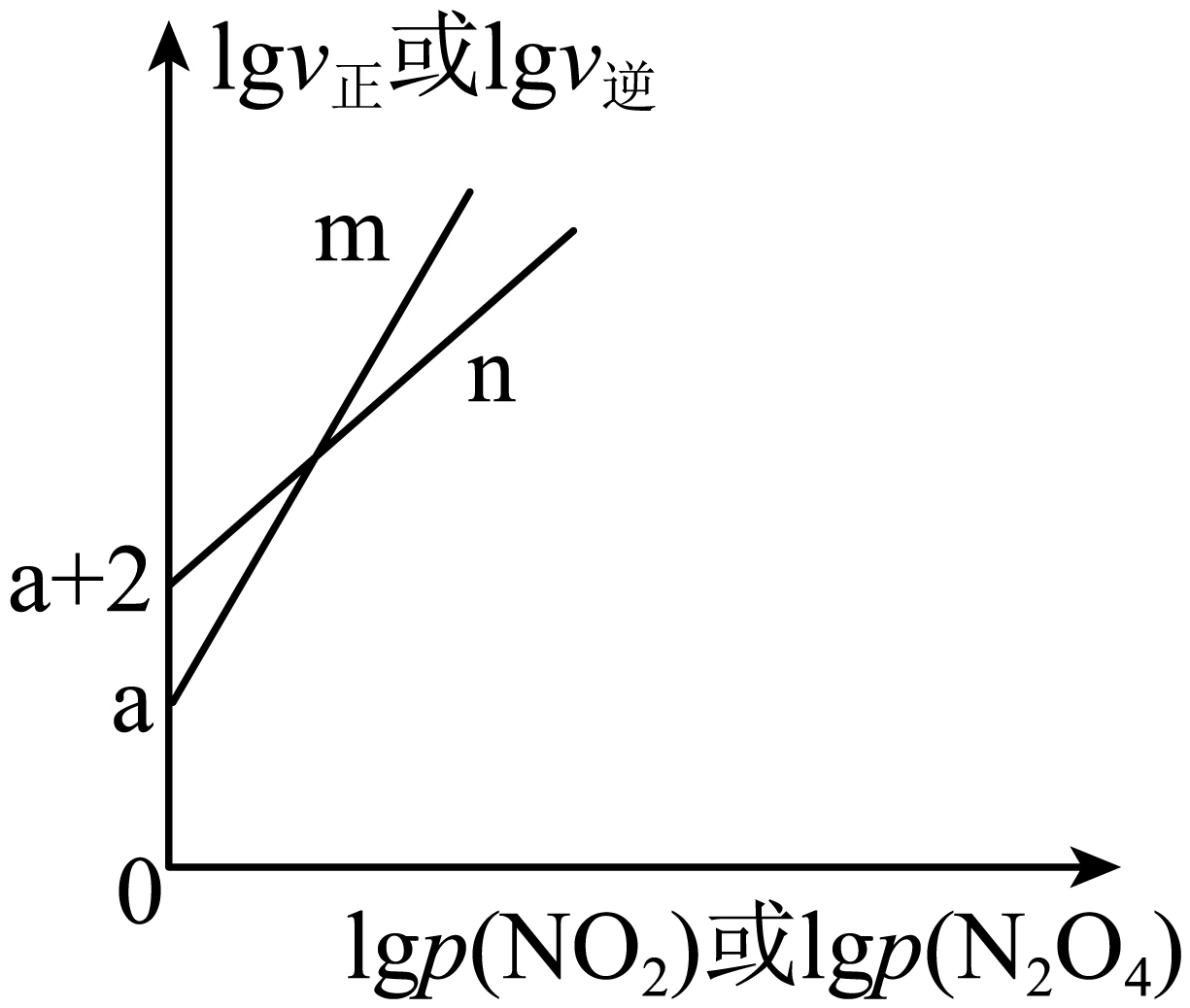
直线$\\text{m}$表示$\\lg {{v}_{逆}}\\sim\\lg p\\left( {{\\text{N}}_{2}}{{\\text{O}}_{4}} \\right)$
","当$2{{v}_{正}}={{v}_{逆}}$时,说明反应达到平衡状态
","$T\\ {}^\\circ \\text{C}$时,该反应的压强平衡常数${K_ p=100}$
","$T\\ {}^\\circ \\text{C}$、${ 600\\ \\mathrm{kPa}}$时,$\\text{N}{{\\text{O}}_{2}}$的平衡转化率为$80\\%$
"]该反应的正、逆反应速率与$\text{N}{{\text{O}}_{2}}$、${{\text{N}}_{2}}{{\text{O}}_{4}}$的分压关系为:${{v}_{正}}={{k}_{正}}\cdot {{p}^{2}}\left( \text{N}{{\text{O}}_{2}} \right)$,${{v}_{逆}}={{k}_{逆}}\cdot p\left( {{\text{N}}_{2}}{{\text{O}}_{4}} \right)$,即$\text{lg}\,{{v}_{正}}\text{=lg}\,{{k}_{正}}+2\text{lg}\,p\left( \text{N}{{\text{O}}_{\text{2}}} \right)$,$\text{lg}\,{{v}_{逆}}\text{=lg}{{k}_{逆}}+\text{lg}\,p\left( {{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}} \right)$,则$\lg {{v}_{正}}\sim\lg p\left( \text{N}{{\text{O}}_{2}} \right)$直线的斜率较大,由图可知,直线$\rm m$的斜率较大,所以直线$\text{m}$表示$\lg {{v}_{正}}\sim\lg p\left( \text{N}{{\text{O}}_{2}} \right)$关系,直线$n$表示$\lg {{v}_{逆}}\sim\lg p\left( {{\text{N}}_{2}}{{\text{O}}_{4}} \right)$的关系,据此解答。
$\rm A$.由分析可知,直线$\text{m}$表示$\lg {{v}_{正}}\sim\lg p\left( \text{N}{{\text{O}}_{2}} \right)$的关系,$\rm A$错误;
$\rm B$.当${{v}_{正}}={{v}_{逆}}$时,说明反应达到平衡状态,$\rm B$错误;
$\rm C$.当$\text{lg}\,p\left( \text{N}{{\text{O}}_{2}} \right)\text{=0}$时,$\text{lg}\,{{v}_{正}}\text{=lg}\,{{k}_{正}}=a$,即${{k}_{正}}\text{=1}{{\text{0}}^{{a}}}$,同理可得${{k}_{逆}}\text{=1}{{\text{0}}^{{a+2}}}$,达到化学平衡时,${{v}_{正}}={{v}_{逆}}$,即${{k}_{正}}{{p}^{\text{2}}}\left( \text{N}{{\text{O}}_{\text{2}}} \right)={{k}_{逆}}p\left( {{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}} \right)$,则$T\ {}^\circ \text{C}$时,该反应的压强平衡常数${{K}_{\text{p}}}=\dfrac{p\left( {{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}} \right)}{{{p}^{2}}\left( \text{N}{{\text{O}}_{\text{2}}} \right)}=\dfrac{{{k}_{正}}}{{{k}_{逆}}}=\dfrac{\text{1}{{\text{0}}^{a}}}{\text{1}{{\text{0}}^{a+2}}}=\dfrac{1}{\text{100}}$,$\rm C$错误;
$\rm D$.在保持$T\ {}^\circ \text{C}$、${ 600\ \mathrm{kPa}}$条件下,向密闭容器中充入$1\,\text{mol N}{{\text{O}}_{2}}$气体,设$\text{N}{{\text{O}}_{2}}$的平衡转化率为$x$,列出三段式:
$\begin{matrix} {} & \text{2N}{{\text{O}}_{\text{2}}}\left( \text{g} \right) & \rightleftharpoons & {{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}\left( \text{g} \right) \\起始 \text{/}\left( \text{mol} \right) & \text{1} & {} & \text{0} \\变化 \text{/}\left( \text{mol} \right) & x & {} & \text{0}\text{.5}x \\ 平衡\text{/}\left( \text{mol} \right) & \text{1-}x & {} & \text{0}\text{.5}x \\ \end{matrix}$,则有${{K}_{\text{p}}}=\dfrac{p\left( {{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}} \right)}{{{p}^{2}}\left( \text{N}{{\text{O}}_{\text{2}}} \right)}=\dfrac{\dfrac{\text{0}\text{.5}x}{\text{1}-\text{0}\text{.5}x}\times 600}{{{\left( \dfrac{\text{1}-x}{\text{1}-\text{0}\text{.5}x}\times 600 \right)}^{2}}}=\dfrac{1}{\text{100}}$,可得$x=0.8$,即$\text{N}{{\text{O}}_{2}}$的平衡转化率为$\rm 80\%$,$\rm D$正确;
故选:$\rm D$
高中 | 化学平衡常数题目答案及解析(完整版)
