高中 | 原电池工作原理 题目答案及解析
稿件来源:高途
高中 | 原电池工作原理题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第一节 原电池
原电池工作原理
为了减少工业烟气中余热与$\text{C}{{\text{O}}_{2}}$的排放,科研人员设计了一种热再生电池$\rm --$二氧化碳电化学还原池系统,消除$\text{C}{{\text{O}}_{2}}$的同时产生${{\text{O}}_{2}}$和$\rm CO$,其工作原理如图所示。下列说法正确的是$(\quad\ \ \ \ )$
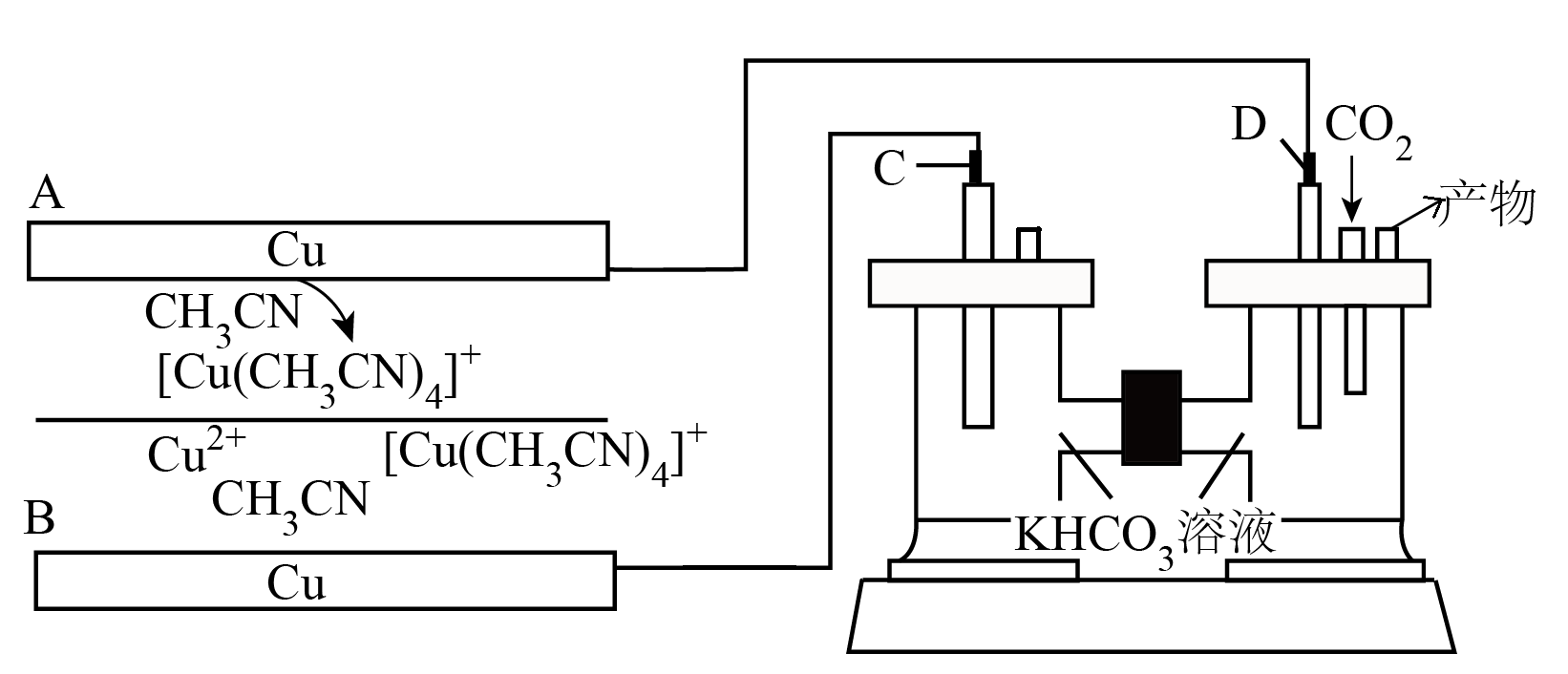
装置中$\\rm A$电极作正极
","工作时,$\\text{HCO}_{3}^{-}$从左向右移动
","阴极的电极反应为$3\\text{C}{{\\text{O}}_{2}}+2{{\\text{e}}^{-}}+{{\\text{H}}_{2}}\\text{O}=\\text{CO}+2\\text{HCO}_{3}^{-}$
","工作时,$\\rm C$电极生成$\\rm 2.24\\;\\rm L($标准状况$\\rm )$氧气,$\\rm A$电极质量减少$\\rm 12.8\\;\\rm g$
"]由装置图可知$\rm A$电极上发生反应:$\text{Cu+4C}{{\text{H}}_{\text{3}}}\text{CN}-{{\text{e}}^{-}}\text{= }\!\![\!\!\text{ Cu}{{\left( \text{C}{{\text{H}}_{\text{3}}}\text{CN} \right)}_{\text{4}}}{{]}^{+}}$,$\rm A$电极作负极,$\rm B$电极为正极,正极发生反应:$\text{C}{{\text{u}}^{\text{2+}}}\text{+4C}{{\text{H}}_{\text{3}}}\text{CN+}{{\text{e}}^{-}}\text{= }\!\![\!\!\text{ Cu}{{\left( \text{C}{{\text{H}}_{\text{3}}}\text{CN} \right)}_{\text{4}}}{{]}^{+}}$,则电极$\rm D$为阴极,电极反应:$3\text{C}{{\text{O}}_{2}}+2{{\text{e}}^{-}}+{{\text{H}}_{2}}\text{O}=\text{CO}+2\text{HCO}_{3}^{-}$,$\rm C$电极为阳极,电极反应:$\text{4HCO}_{3}^{-}-\text{4}{{\text{e}}^{-}}={{\text{O}}_{\text{2}}}\uparrow \text{+2}{{\text{H}}_{\text{2}}}\text{O+4C}{{\text{O}}_{\text{2}}}\uparrow $,据此分析解答。
$\rm A$.装置中$\rm A$电极上发生反应:$\text{Cu+4C}{{\text{H}}_{\text{3}}}\text{CN}-{{\text{e}}^{-}}\text{= }\!\![\!\!\text{ Cu}{{\left( \text{C}{{\text{H}}_{\text{3}}}\text{CN} \right)}_{\text{4}}}{{]}^{+}}$,$\rm A$电极作负极,$\rm A$错误;
$\rm B$.工作时,$\text{HCO}_{\text{3}}^{-}$由阴极向阳极移动,即从右向左移动,$\rm B$错误;
$\rm C$.根据分析可知,阴极的电极反应为$3\text{C}{{\text{O}}_{2}}+2{{\text{e}}^{-}}+{{\text{H}}_{2}}\text{O}=\text{CO}+2\text{HCO}_{3}^{-}$,$\rm C$正确;
$\rm D$.若$\rm C$极生成$\rm 2.24$ $\rm L$ $\rm ($标准状况$\rm ){{\text{O}}_{\text{2}}}$,即生成$\rm 0.1$ $\rm mol$氧气,转移电子$\rm 0.4$ $\rm mol$,结合上述电极反应可知$\rm A$电极消耗$\rm 0.4$ $\rm mol$ $\rm Cu$,质量减少$\rm 25.6$ $\rm g$,$\rm D$错误;
故选:$\rm C$
高中 | 原电池工作原理题目答案及解析(完整版)
